
雑科学ホーム
hr-inoueホーム
● 吸着の話 ●
吸着とは?
理化学辞典などで「吸着」の項を調べると、「気相または液相中の物質が、その相と接触するほかの相(液相または固相)との界面において、相の内部と異なる濃度を保って平衡に達する現象」と書いてあります。なんだかわかったような、わからないような・・・。あらゆる吸着現象を漏れなく含ませようとすれば、このような表現になるのでしょう。もっと一般的に平たく言えば、液体や気体中に溶け込んでいる物質が、別の液体や固体の表面にくっ付く現象のことです。シリカゲルが水を吸うのも吸着ですし、冷蔵庫の脱臭剤が臭いの成分を取るのも吸着です。
なぜ吸着が起こるか
それではなぜ吸着が起こるのでしょうか。自然現象は全体で見れば必ずエネルギーの低い、安定な方向へ向かいます。吸着現象も例に漏れず、フラフラ漂っているよりも吸着した方が安定だから吸着するのです。わかりやすくするために、空気中に漂っている水の分子がガラスの表面に吸着する状況を考えてみます。空気中の水分子は、ときどき空気の分子にぶつかって方向を変えながら、あちこち飛び回っています。たまに別の水分子とぶつかることもありますが、勢いよく飛んでいるので、すぐまた離れて行きます。ところが、温度が下がるとどうなるでしょうか。分子の動きに元気がなくなり、他の水分子にぶつかると、そのままつかまってしまう、ということもしばしば起こるようになります。飛び回る自由さは失いますが、飛び回る元気もないことですし、仲間同士でくっついていた方が安心できる(安定する)のです。あるいは、温度がそのままでも、水分子の数が増えてくると、それだけぶつかる回数も増えますから、中にはつかまるものも出てきます。仲間が大勢いるなら、そのままつかまっておこう、というわけです。このようにして、温度が下がったり、分子の数が増えたりすると水分子が互いに集まり始め、やがては液化が起こります。これが通常の相変化現象です。
ここで、空気中にガラスを置くとどうでしょうか。飛び回っている水分子はガラスの表面にもぶつかります。もし、水分子同士で手をつないでいるよりもガラスの上の方が居心地がよかったら・・・。当然、水同士では集まらないような状況下でも、ガラスの表面にはくっ付いてしまうのです。これが吸着です。厳密に言うと吸着は平衡現象ですから、くっ付いた水分子はそのままくっ付いているわけではなく、くっ付いたり離れたりを繰り返していますが、全体としてみれば、いつも一定の数の水分子がガラス表面にいる状態になるのです(なお、先ほどの液化現象も、実際には集まったり離れたりしながらバランスしている状態です)。つまり、吸着と液化は現象的には同じもので、ただ、くっ付く対象が仲間同士か別のものか、という点が違うだけなのです。ですから液化の場合と同じように、温度を下げたり、水分子の数を増やしたり(つまり水の分圧を上げたり)すると、吸着量は増えて行きます。
吸着等温線
吸着量は温度と圧力によって変わります。そこで、吸着現象を考える際には、普通、一定温度で圧力を変えたときに吸着量がどのように変化するか、を調べます。このグラフを吸着等温線(Adsorption Isotherm)、といいます。くっ付くものとくっ付かれるものとの関係で、いろいろなタイプの吸着等温泉がありますが、ここでは、気体が固体に吸着する際に最も一般的な形の等温線について説明します。図1がその吸着等温線です。圧力(この場合、注目している気体の圧力、つまり分圧)が低いところで急激に吸着量が増え、途中で中だるみがあって、最後にまた一気に吸着量が増大します。
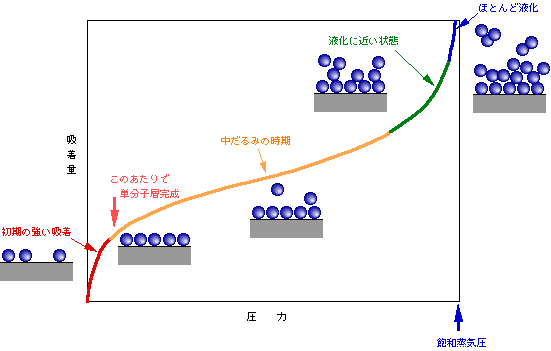
図1 一般的な吸着等温線
初めに吸着量が急増する部分は、ほとんど裸の固体表面への吸着ですから、気体分子は直接に固体表面と手をつなぐことができます。この状況は、固体表面がほぼ一層の気体分子で覆われる(単分子層吸着)まで続きます。ところが、固体表面が大体覆い尽くされて空席が残り少なくなると、運良くその空席にぶつかった気体分子しか吸着できません(気体分子には空席を遠くから見つける能力はありません。ただ適当に飛び回ってぶつかるだけです)。また、一旦席についた分子の中にも、そわそわと席を離れる者も出てきます。その結果、吸着量の伸びが鈍くなるのです。
吸着等温泉の中央付近の直線状の部分では、もうほとんど空席はありませんから、気体分子は既に席についている分子の上に強引に乗っかるようになります(多分子層吸着)。ただし、気体分子同士のつながりは気体分子と固体表面とのつながりほど強くはありませんから、吸着量の伸びはもう一つです。しかし、気体分子の数がさらに増えて(分圧が上がって)来ると、このような弱いつながりでも無いよりはまし、ということで、気体分子がどんどん重なって行く状態になります。上から重なる気体分子から見ると固体表面はずっと下のほうに隠れているのですが、それでも多少の影響力はあるのです。
さらに気体分子が増加すると、もう固体表面は関係なく、気体分子同士が空中でも手をつなぐようになります。こうなると、もう吸着ではなく液化状態です。吸着等温泉の最後の急上昇は、このような液化に向かう段階を示しているのです。
ガラスなどの表面に水分子が吸着する例ですと、だいたい相対湿度4〜5%あたりでほぼ単分子層吸着になり、それよりも湿度が上がってくると2層、3層と吸着層が増えて行きます。冬場の乾燥した気候では湿度は20%以下になりますが、それでも大抵の固体表面は単分子層以上の水に覆われている、ということです。これが梅雨時で湿度80%、などという状態になると、固体表面はもうベタベタです。そして湿度が100%(つまり水の分圧が飽和蒸気圧)になると完全な液化状態になり、固体表面に露が付くのです。
負吸着という奇妙な?現象
以上で吸着現象がどういうものかがおよそおわかりいただけたと思います。ここで、ちょっと面白い現象として、負吸着についてお話しましょう。
「負吸着」、つまり吸着が「マイナス」とはどういうことでしょうか。一番最初に書いた吸着の定義をもう一度見てみましょう。「吸着」とは、「気相または液相中の物質が、その相と接触するほかの相(液相または固相)との界面において、相の内部と異なる濃度を保って平衡に達する現象」、とあります。この「相の内部と異なる濃度」、というのがミソです。「相の内部よりも高い濃度」とは言っていないのです。実は「表面の濃度が相の内部よりも低い濃度」になるのが負吸着なのです。
この現象は、一般に気体の吸着では観測されません。液体からの吸着に特有の現象と言ってよいでしょう。液体中では、その液体に溶け込んでいる物質、つまり溶質は、液体本体(溶媒)の分子に取り囲まれています。溶質分子同士で集まっているよりも溶媒分子に囲まれた方が安定だからで、そうでなければ溶質分子が集合して析出する、つまり溶けないはずです。ここに第3の成分、固体表面が登場します。溶質分子は、溶媒分子に取り囲まれているべきか、新しく出てきた固体表面に鞍替えするかを判断することになります。ここで固体表面の方が居心地がよい、となれば溶質分子は溶媒分子を振って、固体表面に吸着します。これが普通の正吸着です(図2(a))。
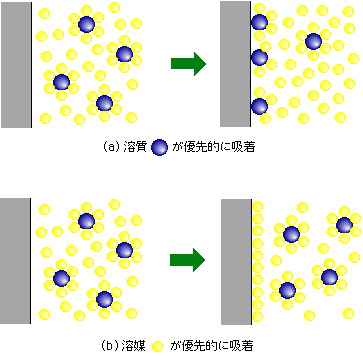
図2 正吸着と負吸着の状態
ところが、固体表面にくっ付くのは、何も溶質分子だけではありません。溶媒分子だって吸着する権利はあるのです(「溶媒」、「溶質」という区別自体が厳密なものではありません。混合物の中で、量の多い方を「溶媒」、少ない方を「溶質」と呼んでいるにすぎません)。ですから、もし溶媒分子の方が溶質分子よりも吸着しやすかったら・・・、固体表面は溶媒で覆われて、溶質分子には入り込む余地がなくなります。その結果、固体表面での溶質の濃度が液の沖合いよりも低くなる、負吸着の現象が起こるのです(図2(b))。もうおわかりでしょう。溶質にとっての負吸着とは、溶媒の正吸着のことなのです。気体の場合は、吸着の対象になる物質(例えば空気中の臭い成分など)に比べて溶媒に相当する気体分子(例えば空気中の窒素や酸素)の吸着力が極端に弱いですから、このような負吸着は起こらないのです。もしも窒素や酸素の吸着力が強かったら、そもそも気体として自由に飛び回ることはないはずですから。
ところで、固体表面での溶質濃度が液の沖合いよりも低いと言っても、全く吸着していないわけではありません。百歩譲って、固体表面が完全に溶媒分子で覆われて溶質が全く吸着していなくても、それは吸着ゼロということであって、マイナスではないはずです。それなのになぜ「負吸着」なのでしょうか? その疑問を解くカギは、通常の吸着量測定の方法にあります。
普通は、吸着量は図3のようにして計ります。
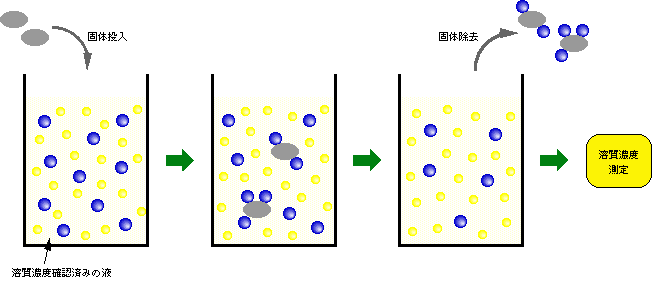
図3 吸着量の測定方法
まず、固体を入れていない状態で、溶質の濃度を調べておきます。ここに固体を投入すると、溶質の一部は固体表面に吸着します。そこで、遠心分離や濾過などで溶質をくっ付けた固体を取り除き、残った液の溶質濃度を測定すれば、その減少分から、固体に吸着した溶質の量を求めることができます。この方法では、図3からわかるように、溶媒が固体に吸着することは考えていません。実際に、通常は溶媒の量は溶質の量に比べてはるかに多いですから、少しぐらい溶媒が吸着して固体と一緒に取り除かれても、その影響はほとんどないのです。例えば、溶質が100個、溶媒が10000個あったとして、その中の10個ずつが固体に吸着したとしましょう。液中に残った数は、溶質が90個、溶媒が9990個ですから、溶質は1割減ですが、溶媒はたった0.1%しか減っていません。溶媒が全く吸着していないと見なしてしまっても、誤差は1%もないのです。
ところが、初めの液が濃くなるとそうは行かなくなります。「液が濃い」ということは、「溶媒と溶質の量の差が小さい」ということですから、溶媒が減った分は無視できません。溶質と溶媒が共に100個ずつあった場合を考えましょう。溶質濃度は50%ですね。このうち10個ずつが固体に吸着して取り除かれると、残りは共に90個です。溶質濃度はやはり50%・・・。あれっ、変化していない? そうです。図3のような測定法では、この場合、吸着量はゼロ、となってしまうのです。それでは、溶質が100個で溶媒が50個の状態から、10個ずつ吸着したらどうなるでしょうか。今度は残った液中の溶質は90個、溶媒は40個です。溶質濃度は、何と、初めよりも高くなってしまいました。あたかも固体が新たに溶質を吐き出したかのように見えるわけで、見かけの吸着量はマイナスになってしまうのです。この様子を模式的に示したのが図4です。
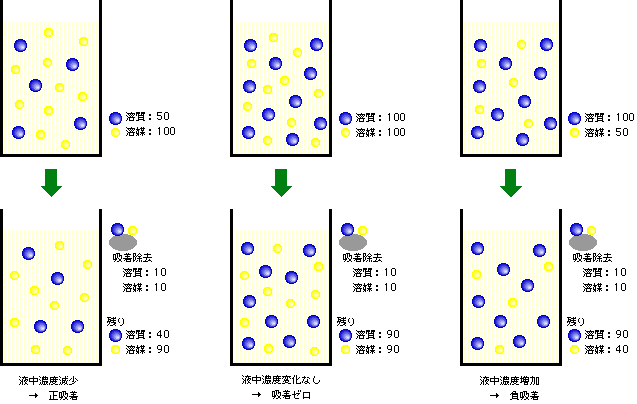
図4 正吸着、負吸着の時の濃度変化
横軸に吸着後の液の濃度、縦軸に図3の方法で求めた吸着量(溶媒の吸着を無視した見かけの吸着量)をとってグラフにすると図5のようになります(ただし、このようなきれいな直線になるのは、濃度が変わっても固体表面に実際に吸着している溶質、溶媒の量が一定である場合に限られます。例えば先の例のように、いつも溶質と溶媒が10個ずつ吸着するような場合です)。溶質濃度が高くなるに従って、見かけの吸着量は減って行き、あるところで吸着量はゼロに、その先ではマイナスになります。実際には溶質もちゃんと吸着しているのに、見かけ上はこのようにマイナスの吸着量が現れることから、「負吸着」と呼ばれるのです。
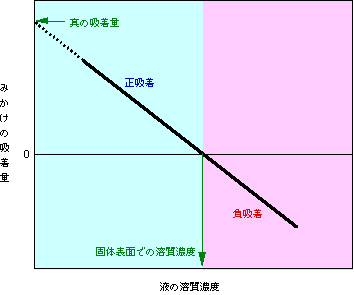
図5 見かけの吸着量のグラフ
見かけの吸着量ゼロの点は、実は、固体表面での溶質濃度に相当します。先ほど説明したように、固体から離れた部分の液の濃度と固体表面での濃度が同じなので、固体があってもなくても液の濃度が変わらず、見かけ上は吸着しているようには見えないのです。それよりも右の領域では、固体表面の溶質濃度が液内部よりも低い(溶媒の割合が多い)ので、液中では逆に固体があった方が溶質の割合が増え(溶媒の割合が減り)、見かけの吸着量はマイナス、つまり負吸着になります。一方、斜めの直線を左上方に延長して縦軸と交わる点では、極限まで希薄にした溶液からの吸着に相当しますから溶媒の吸着は無視できて、見かけの吸着量と本当の吸着量が一致します。つまりこの点は、溶質の真の吸着量を表しているのです。このように、濃度を変えて見かけの吸着量を測定すると、いろいろなことがわかってきます。このあたりの計算も含めた説明は、
博士論文
の第2章にも詳しく書いています。
吸着のもとになる力
これまで、吸着が起こる理由を、「安定である」とか「居心地がいい」とかで表現してきましたが、このような「安定性」、「居心地のよさ」を作り出すもとになるものは何でしょうか。一言で言えば、それは互いが引き合う力です。この「互いが引き合う力」にはいろいろありますが、大きく、分散力と静電的な力の2種類に分けられます。
分散力はファンデルワールス力の中心となる力で、あらゆる物質間にはたらきます。細かい説明は省略しますが、一言でいえば、電気的に中性の分子でも瞬間的に見れば正負の電荷が偏った状態になっており、この電気的な偏りで互いに引き合う、というものです(図6(a))。
これに対して静電的な力は、少なくとも一方が永久的な電荷または電荷の偏りを持っているときに発生します(「
静電場の話」参照)。例えばガラスは、プラスに偏ったケイ素とマイナスに偏った酸素からできており、さらに一番表面では酸素の先にプラスに偏った水素が付いています。また、
卒業論文に出てきた
ゼオライトでは、結晶中にプラスの金属イオンを持っています。これらの電荷により、その表面には電場とよばれる電気的な場が作られています。この電場に、イオンや電荷の偏りを持った分子(双極子と呼びます)が近づくと、図6(b)のように電気的な強い引力(場合によっては反発力)がはたらくのです。また、このような電場を持った表面に電気的に中性の分子が来た場合でも、電場によって無理やりに電荷が偏らされて、やはり引力がはたらきます。これは、磁力をもたない鉄が磁石によって強制的に磁化されて吸い付けられる現象とよく似ています。この他にも、双極子が2つセットになった四重極子というものも、電場で力を受けます。
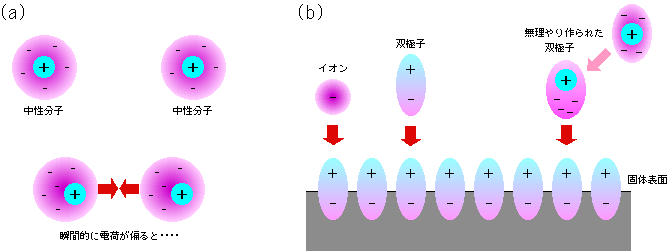
図6 吸着を引き起こす力のもと
表面と分子との相互作用は、実際にはいろいろと複雑で、そう簡単に解釈できるものではないのですが、大雑把に言うと、こんなところでしょう。
雑科学ホーム
hr-inoueホーム






