
雑科学ホーム
hr-inoueホーム
● 結晶の話 ●
整列する原子・分子
原子や分子は温度が高いと自由に動き回ります。一箇所にとどまっているよりもいろいろな場所に移動できる方が自由度が大きく、エネルギー的に有利だからです。元気者は外を自由に駆け回ることに大きな魅力を感じる、というわけです。しかし、温度が下がって原子や分子の動きが悪くなると(と言うか、動きが悪くなった状態が温度が低い状態なのですが)、大きく動き回るメリットが少なくなり、お互いに引っ張り合って一定の場所に落ち着くようになります。動き回る自由度よりも、互いに引き合うことで手に入れる安定度の方が勝るのです。この時、できるだけたくさんの仲間に囲まれた方が落ち着きが良くなりますから、でたらめに集まるよりも、規則的に並ぼうとする傾向が出て来ます。これが、原子や分子が規則的に配列した固体、つまり結晶です。
同じ大きさのボールを箱にたくさん入れて揺すってみましょう。すると、ボールが規則的に並んで6角形に配列した部分が多く見られるようになります。またちょっと変な例ですが、満員電車の中の人の配置もけっこう面白くて、一見何の規則性もないように見えますが、よくよく見てみると、一人の周りにくっついている人数は6〜8人でほぼ一定している場合が多いのです。これらはいずれも、同じ体積の中にできるだけたくさん詰め込もうとしてできたパターンです。
固体の中の原子や分子も同じで、引き合う相手が多い方が安定になる傾向があります。引き合う相手が多い、つまり多くの仲間に囲まれているほど居心地がいいわけで、結果として狭い範囲に多く詰め込まれた形になるのです。分子が球形ではなく、いびつな形をしている場合には、先のボールの例とは違って、互いに斜めに向き合ったり、半分ずつズレて重なったり、と色々と策を弄しますが、お互いが引き合って安定な形を作ることに変わりはありません。結晶とは本来、こういう自然の成り行きでできたものです。
結晶の種類
結晶には、構成単位(原子、分子、イオン)が引き合う「力」の種類によって、「イオン結合性結晶」、「共有結合性結晶」、「金属結合性結晶」、「分子性結晶」の4種類があり、結晶の形によって、「三斜」、「単斜」、「斜方」、「三方」、「六方」、「立方」の6種類があります。これらのことはいろいろな教科書類に詳しく書かれているので、ここでは図1に大雑把にまとめるだけにしておきます。実際の結晶では、これらの形が基本単位となって、空間がびっしり埋め尽くされることになります。
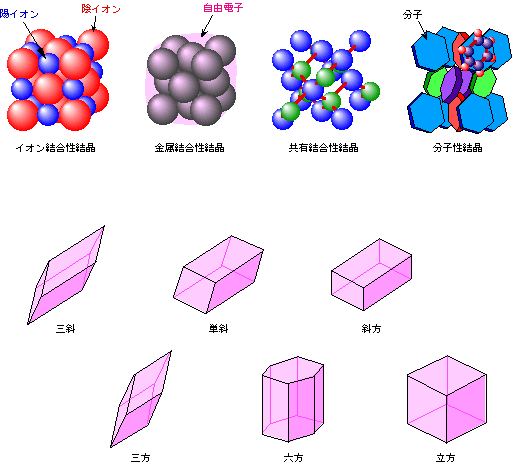
図1 結晶の種類
ところで、英語で「結晶」を意味する「Crystal」という単語には、「水晶」という意味もあります。大きな六角柱の形が独特で古くから人目を引いて来た結晶の代表選手、ということでしょう。この水晶は、成分から言えばガラスと同じ二酸化ケイ素(シリカ)です。何のことはない、ケイ素が酸化した(極端な言い方をすれば、錆びた)もので、ケイ素の周りに4個の酸素が付き、それぞれの酸素の先に別のケイ素がつながった構造をしています。
ガラスではこの基本構造は維持されているものの、全体の配置はデタラメで不規則な網目状になっています。これに対して、独特の螺旋構造に結晶化したのが「石英」で、その中で宝飾品に使えるような大きな六角柱の外形を示すものを「水晶」と呼んでいるようです(もっとも、この定義はあまり厳密なものではありませんが)。二酸化ケイ素には、石英の他にもクリストバル石や鱗珪石といった別の結晶形があります。それぞれに、特定の温度や圧力の時に最も安定になる形なのですが、一旦その形が出来上がってから冷えてしまうと、そう簡単には形を変えることはできませんので、結局は全ての形が普通の状態で存在しています。
同じような例は他にもたくさんあります。例えば炭素。六角形に炭素が配置した、例の「亀の甲」が平面状に広がり、その平面が重なったのが「グラファイト(黒鉛)」、正四面体の頂点に来るように炭素が配置したのが「ダイアモンド」です。両者が似ても似つかないものであることはご存知でしょう。一方はものが燃えた時に出るススであり、もう一方は宝石です。
結晶のみかけの形
形で分類した結晶の種類は図1の下側に示した通りなのですが、気をつけなければならないのは、これが必ずしも結晶の外形にはならない、ということです。図1は結晶の中の原子やイオンの並び方を示したものですが、実際にはこれを対角線で切ったような面が表に出てくることもあるわけで、どの面が現れるかでみかけの形は大きく変わるのです。その例をお見せしましょう。
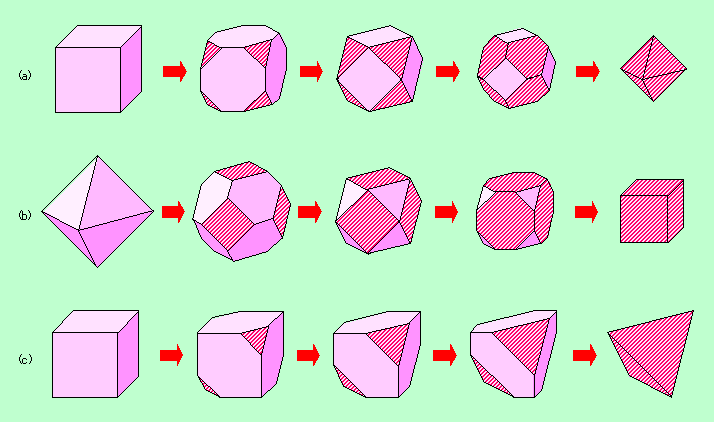
図2 立方体や八面体の角を落とすと・・・・・
図2(a)は立方体の角を切り落として行った時に形がどのように変わるかを示しています。切り落とした面は初めは正三角形ですが、それが互いにくっつくようになると六角形になり、ついには逆向きの正三角形になって全体が正八面体になってしまいます。反対に図2(b)のように正八面体の角を切り落として行くと、今度は切り口が正方形から八角形に変わり、(a)とは逆の経過を辿って立方体になってしまいます。また、立方体の角を全部落とすのではなくて半分の4箇所だけ落とすと、図2(c)のように最後は正四面体になります。このように、どの面が表に出るかで、見た目の印象はずいぶん変わって来るのです。
図3には、さらに違った見方を示しました。この図は、立体を切った時にどのような切り口が現れるかを示したものです。
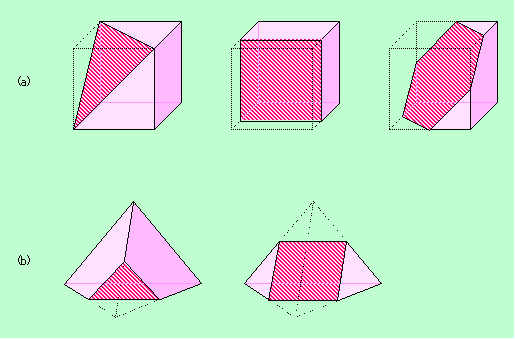
図3 立体の中に含まれる別の形
図3(a)は立方体を切ったものですが、切り方によって、三角形、四角形、六角形が現れます。また、図3(b)の正四面体の例では、うまく切ってやると正方形が出て来ることがわかります。このように、同じ結晶系に属する結晶でも、その外形はいろいろと変化に富んだものになります。さらに同じ化合物の結晶であっても、結晶が成長する条件によって主に成長する面が変わるために、全く違った形になることもよくあるのです。
結晶と宝石
先ほど水晶とダイアモンドの例が出てきましたが、世の中で宝石として珍重されているものは、ほとんどが結晶であると言ってよいでしょう。宝石に要求される性質としては、「見た目が美しいこと」と「硬いこと」、それに「産出量が少ないこと」が挙げられますが、これらの条件を満たすには、結晶であることが重要になります。
「見た目の美しさ」には屈折率が関係している場合が多々あります。屈折率が大きいと光が内部で全反射しやすいので、うまく加工(カット)してやると、外から入って来た光がほとんど弱められずに再びいろいろな方向に向かって外に出て行き、キラキラと輝いて見えるのです。普通、屈折率は密度が大きいほど大きくなりますから、原子がびっしり詰まった結晶が有利なわけです。また、内部に原子配列の乱れた部分や結晶の境目があると、そこで光が変に散乱されてしまいますので、宝石としては、乱れのない、できるだけ完全な結晶が必要なのです。
「硬さ」も密度に関係します。スカスカの状態よりも密に詰まった状態の方が、当然硬くなります。また原子どうしの結びつきの強さも硬さには重要な要素です。その意味で、共有結合性結晶やイオン結合性結晶が有利なのは言うまでもありません。「産出量」は結晶とは直接関係はなさそうですが、宝石になるようなきれいで大きな結晶は高温、高圧の特別な条件が揃わないとできませんから、「大きな完全結晶」=「珍しい」、という図式は成り立つでしょう。
ここで、主な宝石の成分をざっと見てみましょう。あまり中身を知ると、ありがたみが薄れるかもしれませんが・・・・・。
ダイアモンドは炭素だけからできています。同じ炭素でできたグラファイトと比べて密度は1.5倍以上、硬さ(モース硬度)は、グラファイトの1〜2に対して最高の10です。この硬さを活かして、人工的に作ったものが研磨剤やガラス切りに使われていることはご存知でしょう。またダイアモンドは基本的には絶縁体ですが、
半導体の性質を持たせることもでき、エレクトロニクス材料としても注目されています。
ルビーやサファイアは酸化アルミニウムです(錆びたアルミ、と言ってしまえば身も蓋もありませんが)。不定形のものが吸着剤や白色顔料に使われるアルミナで、結晶化したものはコランダムと呼ばれます。このコランダムにクロムが混じった(アルミニウムの一部が置き換わった)ものが赤色のルビー、鉄とチタンが混じったものが青色のサファイアですが、赤色以外のものはみんなサファイアと呼ぶようで、高級腕時計や高圧容器の窓材に使われるサファイアはほとんど無色です。ルビーの使い道として面白いのはレーザーでしょう(
発光の話参照)。円柱状に加工したルビーにキセノンランプなどの強い光を当てると、ルビーに含まれているクロムの電子が高いエネルギー状態に飛び上がり、そこから少し低いエネルギー状態に落ちて溜まります。この溜まった電子が一気に元の状態に落ち込む時に、よく揃った赤色のレーザー光を発するのです。裸のクロム原子ではこのような都合のよいエネルギー状態にはなりません。コランダムの結晶の中で、周りの他の原子の影響を受けて初めてできる状態なのです。
先に書いたように、水晶はケイ素と酸素、ルビーやサファイアはアルミニウムと酸素の化合物ですが、実は地球上で最も多いのは、ケイ素とアルミニウムの両方を含んだ酸化物です。そこらに転がっている石のほとんどはこの種の化合物で、ケイ素とアルミニウムの他にいろいろな金属を含んだ「長石」と呼ばれるケイ酸アルミニウムの結晶が主成分なのです。もちろん普通の長石は宝石にはなりません。いくらでも採れますし、大部分のものは不透明できれいではありませんから。ところが、ケイ素とアルミニウムを主成分とした鉱物の中にも宝石になるものがあります。例えば、ベリリウムを含んだ結晶は透明性のある六角柱状で、ベリル(緑柱石)と呼ばれます(ベリリウムはアルミニウムよりも多く含まれていますから、ルビーの時のクロムのような不純物ではありません)。これの緑の濃いものがエメラルドで、鉄が混じって青色になったものがアクアマリンです。
トルマリンは、ケイ素とアルミニウムの他にホウ素やら鉄やらが組み合わさった酸化物です。この化合物は、結晶中のイオンの位置関係からプラス電荷の中心とマイナス電荷の中心がずれています。普通はそのずれを打ち消すイオンが表面に付いて全体としては中性になっていますが、熱を加えるとその状態が変化して、結晶の両端にプラスとマイナスの電荷が現れる性質を持っており(
誘電体の話 2参照)、電気石と呼ばれます。このような特異な性質があるために、最近、トルマリンを使った健康グッズがいろいろと出回っているようです。本当の効果の程はわかりません。ただ、説明書きを見る限りでは、少々怪しげなものが多いように思えるのですが・・・・・。
スピネルはマグネシウムとアルミニウムの酸化物ですが、これと同類の結晶構造全体を指す名前にもなっています。その中に、鉄の酸化物で、磁性材料として有名なマグネタイトやマグヘマイトがあります。またザクロ石(ガーネット)は、これまた同じ結晶構造の一群の酸化物の総称で、ケイ素の他にカルシウムや鉄、マンガン、アルミニウムなど、種類によって色々な元素を含んでいます。レーザーの発振に使われるYAG(イットリウム-アルミニウム-ガーネット)や、メモリー材料の基板に使うGGG(ガリウム-ガドリニウム-ガーネット)などもザクロ石の仲間です。その他に、ジルコニウムの酸化物も宝石としてよく知られています。ジルコニウム単独の酸化物がジルコニアで、ジルコニウムとケイ素の酸化物がジルコンです。
こうして見ると、ダイアモンドを除いてほとんどの宝石が酸化物であることがわかります。あとで説明しますが、透明で、鮮やかな着色をするには酸化物が都合がよいのです。もちろん、結晶性が悪いものはダメで、十分に大きな、質の良い結晶が必要なのは言うまでもありません。
結晶の透明性と着色
金属を除いて、大部分の結晶は透明ですが、それはなぜでしょう。そもそも「透明」とはどういうことでしょうか。まずはここから考えてみることにしましょう。
ある物体に光が当たった場合、その一部は物体の表面で反射されます。反射されずに中に入り込んだ光は、今度は物体の内部で散乱されたり吸収されたりします。そして、散乱や吸収を免れた光だけが、再び物体の外へと出て来ることになります(出口で反射して中に戻される光もありますが)。この外に出て来る光が多い場合が「透明」ということになります。
金属の場合、結晶の中を自由に動き回る自由電子がたくさんあります。ここに光がやって来ると、光は振動する電場(と磁場)ですから、その振動に引きずられて自由電子が振動します。電子は光の電場を打ち消す方向に振動しますから、光はそれ以上奥に入ることはできません。一方、振動する自由電子からは新たな電磁波、つまり光が出ますから、結局、入って来た光をそのまま送り返す形になり、光が反射されることになります。これがいわゆる「金属光沢」の起源です。このように、自由電子を持つ金属では大部分の光は表面で反射され、通り抜けることができません。ついでに言うと、有機の高分子の中で導電性のある物がありますが、これらも普通は黒光りする金属光沢を持っています。
これに対して自由電子を持たない、つまり導電性のない結晶では、金属のような表面での光反射は起こりません。また、結晶を構成する原子やイオンの並ぶ間隔は光の波長の1/1000程度ですから、光を散乱することもありません。これは、例えば波長が5mの海の波の中に直径5mmの棒を立てても、波の動きに何の影響もないのと同じようなものです。結晶の中に光の波長程度かそれよりも大きな欠陥や歪みがあると、そこでは光が散乱されて白く濁って見えますが、完全な結晶では光はほとんど散乱されないのです。こうなると、光の吸収さえ起こらなければ、その結晶は光を透過する、つまり「透明」である、ということになります。
光の吸収には、結晶の中の電子のエネルギー状態が関係します。
半導体の話に書いているように、絶縁体や半導体では、電子が取ることのできるエネルギー状態は飛び飛びになっています。低いエネルギー状態は電子で一杯になっていますが、高いエネルギーの部分はほとんどカラッポで、その間にはバンドギャップと呼ばれるエネルギーの隙間(電子が取ることのできないエネルギーの状態)があります。
半導体の話では、これを二階建てのビルに例えました。一階は一杯で、二階はカラ。一階から二階には、外からエネルギーをもらわなければ飛び上がれない、というわけです。この外から与えるエネルギーとして有効なのが光であり、電子は光を吸収して高いエネルギー状態に飛び上がるのです(図4)。
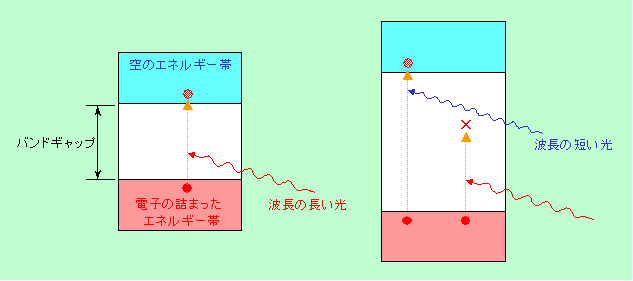
図4 絶縁体や半導体結晶の光吸収
バンドギャップの大きさは物質によっていろいろで、ギャップが小さければエネルギーが小さい赤い光でも吸収できますが、ギャップが大きくなると、エネルギーが大きい紫の光でも不足し、紫外線が必要になります。つまり、バンドギャップの小さい物質は可視光線を吸収して不透明になり、バンドギャップの大きい物質は可視光線を全部透過して透明になる、というわけです。バンドギャップが小さいと熱エネルギーによっても電子の飛び上がりは起こりますから、多少は導電性が出ます(例えばケイ素やゲルマニウム)。ですから、先ほどの自由電子による反射と合せて、非常に乱暴な言い方をすれば、「電気を通しにくい物質ほど光を良く通す」ことになるのです。その意味で、宝石に多い酸化物の結晶やダイアモンドは電気を通さず透明性が高い、ということになります。
このように、結晶の多くは無色透明であるはずなのですが、実際には宝石の例を引くまでもなく、色が付いている場合が多くあります。これは結晶中に含まれる不純物のためです。ルビーの赤色などはその典型で、コランダム自体は無色透明なのですが、微量に(普通は1%以下)含まれるクロムが青系の光を吸収するために赤く色付くのです(ルビーは実際には青い光を吸収するだけではなくて、レーザー発振で少し触れたように赤い光を出す性質も持っています)。また、何らかの原因で結晶を構成する原子やイオンのごく一部が脱落したり、本来あるはずの場所からズレたりすると、そこが光を吸収して色が付く場合もあります。例えば、酸化チタンの結晶は真空中で加熱すると酸素の一部が除かれて、青っぽい色を示すようになります。このような不純物や欠陥による色が鮮やかに付くためには、元の結晶が完全に近く、透明性が高くなければなりません。欠陥や乱れの多い結晶では、その中に特殊な働きをする部分を埋め込んでも、目立った効果は見えなくなってしまうのです。
結晶の形を見る −X線回折−
これまでに結晶の形などについて「見て来たような」話をして来ましたが、光の波長よりも小さい構造をどうやって知るのでしょうか。そもそも、「何かを見る」ためには、対象に信号を送り込んで、そこから帰ってくる信号の変化(強さとか方向とか)を捕まえる必要があります。可視光線は大半の結晶を素通りしてしまいますから、信号としては使えません。そこで結晶の構造を見るためには、もっと波長の短いX線や電子線を使うことになります。
最も普通に使われるのはX線です。X線は金属などのターゲットに電子線をぶつけることで発生させますが、ターゲットとして銅を使った場合、発生するX線の波長は約0.15nmです。結晶の中の原子やイオンの間隔もこのぐらいですから、ちょうどうまくX線を散乱してくれるのです。X線を使った結晶構造の解析は化学系の人には常識でしょうが、一応、ざっと見ておきましょう。
原子やイオンが1個だけだと、X線は単に四方八方に散乱されるだけです。ところが複数の原子が並んでいると、それぞれの原子からの散乱X線の波が重なり合って干渉を起こします。波の山と山、谷と谷が重なる場合は強め合い、山と谷が重なる場合は弱め合うのです。その様子を図5に示しました。
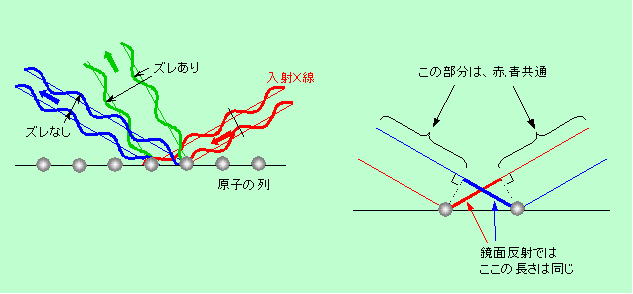
図5 一列に並んだ原子による散乱X線の干渉
原子の列にX線が当たるといろいろな方向に散乱されますが、例えば左図の緑の散乱線の場合、隣り合った原子から散乱されたX線の波の山の位置がズレています。2つの原子は位置が違うのですから、それぞれに当たって散乱されたX線は通ってきた距離(光路の長さ)が違うことになり、このように波がズレてしまうのです。ほとんどの方向でこのような状態になり、散乱されたX線は互いに強め合うことができません。ところが、左図に青で示したように、ある特定の方向ではX線の光路差がなくなって、散乱線どうしが強め合います。その特定の方向とは、ちょうど原子が並ぶ面に鏡を置いて反射させた方向であることが右図からわかると思います。つまり、あたかも原子の列で鏡面反射されたかのように、その方向にだけ特に強い散乱線が出るわけです。これが、一列に並んだ原子によるX線の回折現象です。
それでは、このような原子の列が何列もあるとどうでしょうか。今度は、初めのX線をどの方向から入れるかが重要になります。図6(a)の場合には、1列目からの回折線と2列目、3列目からの回折線の山や谷の位置がズレているため、それらが打ち消しあって、強い回折は出て来ません。しかし図6(b)の場合には、各列からの回折線がピッタリ合っていますから、その方向に強い回折が起きるのです。つまり、1列の時には初めのX線の方向に関係なく鏡で反射した方向に回折線が出ていたものが、列がたくさん並ぶと、特定の方向から入って来るX線しか回折できなくなってしまうのです。
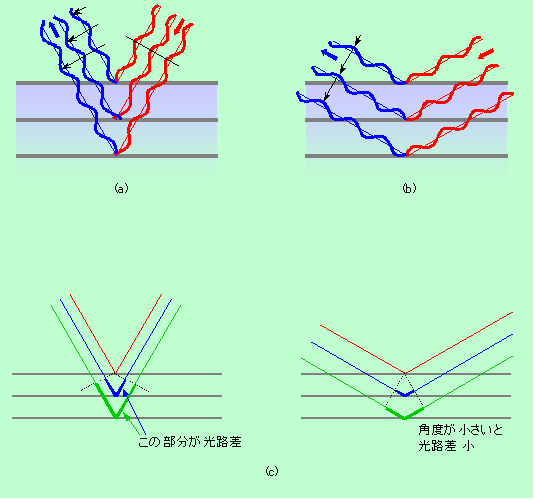
図6 列がたくさんある時のX線の回折
この回折現象は、1列目で回折されたX線と2列目、3列目で回折されたX線が通ってきた距離の差が、X線の波長にピッタリ一致した(または波長の2倍、3倍というような整数倍になった)時に起こります(図6(c))。ちょうど波長分だけズレて元と重なるのです。この状況は、同じ間隔の列が3つになっても4つになっても変わりません。2列の時にX線が強め合った方向は、3列でも4列でもやはり強め合うのです。実際の結晶は3次元ですから、図5や図6の画面に垂直な方向にも原子は並んでいます。ですから、改めて3次元の世界で回折が起こる条件を表せば、「一つの結晶面(原子が並んだ平面)だけの場合にはその面で鏡面反射する方向にX線の回折が起こるが、結晶面が何層も重なった現実の結晶では、各層からの回折線の光路差が波長の整数倍になる方向にのみ回折が起こる」ということになります。
この性質を利用すると、回折が起こる方向を調べることで、結晶面の間隔を知ることができます。例えば図7のような結晶があったとします。この結晶の(a)の面では、図のような面スレスレの浅い角度でX線を当てた時に回折線が出るのに対して、(b)の面ではもっと大きい角度のX線でのみ回折が見られたとしましょう。図6(c)からわかるように、光路差はX線を大きな角度で入れるほど大きくなりますから、(a)面と(b)面では、(b)面の方が面間隔が狭いことになります(面間隔が狭いために、大きな角度でX線を入れて光路差が十分大きくなるようにする必要があるのです)。もちろん、ちゃんと計算すれば、実際の面間隔を数値で求めることができます。このようにいろいろな方向からX線を照射して(現実にはX線の向きを変えるのは大変なので結晶の方をくるくる回しますが)測定をすれば、結晶構造が見えてくるわけです。
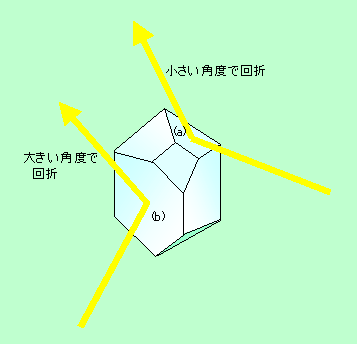
図7 結晶でのX線回折測定
大きな1個の結晶ではなくて、粉末のような多数の小さな結晶が集まったものである場合には、初めからいろいろな方向を向いた結晶がありますから、試料をくるくる回す必要はありません。粉末にそのままX線を照射すれば、多くの中にはたまたま方向がピッタリ合った結晶も必ず含まれていますから、ちゃんと回折線が出ます。図8にその様子を模式的に示しました。
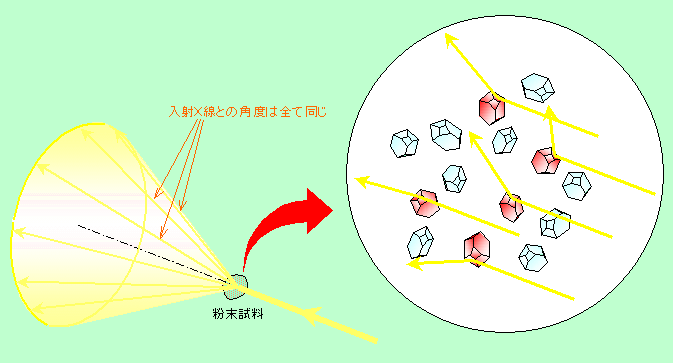
図8 粉末の場合のX線回折
右から入って来たX線に対して、図の赤色に着色した結晶は、一つの結晶面が偶然にちょうどよい方向になっているため、回折を起こします。ここで重要なのは面とX線との角度ですので、赤色の結晶について、入射するX線の方向を軸にして結晶を回転させても(面とX線との角度は変わりませんから)、回折線が出るための条件は維持されます。というわけで、同じ面からの回折線は図のように円錐の側面を通るように出て行き、左手に置いたフィルムやスクリーン上に円を描くことになるのです。この状況は別の結晶面についても同じことで、ただ回折の角度が違うだけです。ですから実際の粉末試料でのX線回折では、各結晶面の面間隔によって半径の異なる多数の同心円が観測されるのです。もちろん、面間隔が狭い結晶面ほど大きな角度で回折を起こしますから、円の半径は大きくなります。また、粉末の粒子の数が少ないと、回折を起こすことができる粒子の数も当然減りますから、円がきれいにつながらずに、切れ切れになったり数珠のようになったりします。この状態が極端に進むと、大きな結晶が1個だけの時のように、一つの面からは特定の一方向にしか回折が出なくなり(もちろんX線の角度によっては回折が全くでない場合もあります)、スクリーン上には一つの点だけが映ることになります。
余談ですが、X線回折で結晶構造を調べることの裏返しで、構造のわかっている結晶を使ってX線の波長を調べることもできます。実際にEPMAと呼ばれる分析装置では、試料に電子線を当てた時に発生するX線(この波長は試料に含まれている元素によって変わります)を結晶に入れて、出て来る回折線の方向からX線の波長を求めるようになっています。
電子線回折
結晶構造を調べる方法として、先のX線回折の他に電子線回折があります。電子線の波長は加速電圧(電子の飛ぶ速さ)で変わりますが、100kVで加速した場合で0.0037nm。X線よりもさらに2桁下です。電子線回折の専用装置もありますが、普通は電子顕微鏡に付属している機能の一つとして使われます。電子顕微鏡を使った電子線回折の仕組みは
電子顕微鏡の話で詳しく書いていますので、ここでは省略します。ただ、波長の違いから来るX線回折との大きな違いについて触れておくことにしましょう。
図6にも示しているように、回折の方向は結晶の面間隔と照射線の波長との関係で決まります。波長の短い電子線では、1波長分に相当する光路差はほんのわずかで済みますから、非常に浅い角度の照射で十分です。どのくらい浅いかというと、先のX線で30度の角度で回折が起こるような結晶の場合、100kV加速の電子線ではたったの0.7度。1m先でも1cm余りにしか広がらない角度です。そのため、電子線回折を起こす時の試料の結晶面は、電子線に対してほとんど平行になっているように見えます(図9)。
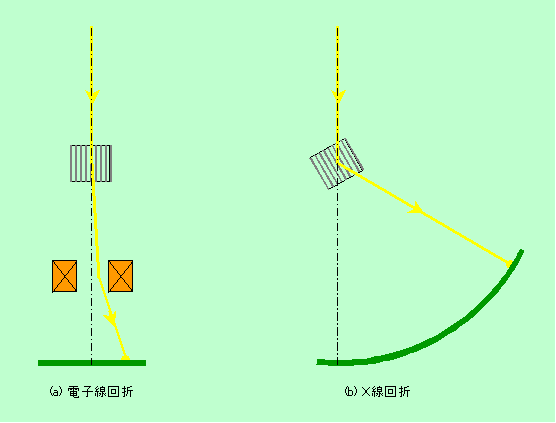
図9 電子線回折とX線回折
このように角度の小さい電子線回折ですが、電子顕微鏡では、試料を何万倍にも何十万倍にも拡大できるのと同じように、電子線回折の像も大きく拡大できます。1度にも満たない方向の回折線でもちゃんと分離した像にすることができますから問題はありません。
結晶のようで結晶でない ― 準結晶 ―
最後に、一見結晶のようでいて実は普通の結晶ではない、「準結晶」について簡単に触れておきましょう。結晶では必ず基本となる単位構造があり、それを使って空間が隙間なく埋め尽くされます。空間を埋め尽くすには、基本構造は図1下に示した6種類のうちのどれかでなければなりません。ここで、立体ではイメージしにくいので平面で考えてみましょう。平面を隙間なく埋めることができる対称性のよい形としては、正三角形、正方形、長方形、平行四辺形、ひし形、正六角形があります。これに対して、正五角形や正八角形、正十角形などは必ず隙間ができてしまいますから、基本単位にはなれません。というわけで、結晶の世界には五角形はない・・・・・はずでした。ところが、1984年に正五角形に相当する対称性を持った合金が発見されました。電子線回折で、ちゃんと五角形の回折パターンが出たのです。この物質が詳しく調べられた結果、図10のような構造を持っていることがわかりました。

図10 準結晶の基本パターンの例
ちょっと見ると規則性があるようですが、よくよく見れば、同じ形が規則正しく並んでいるのとは様子が違っています。それでも五角形、十角形を基本とした構造は確かにあるのです。これが準結晶と呼ばれるものの代表的なパターンで、その後も、いろいろな組成の合金で準結晶と考えられるものが見つかっています。これらの準結晶は、大抵の場合、金属を高温で溶かした状態から急冷することで作られます。その点ではアモルファス(非晶質)とよく似ていますが、アモルファスが比較的不安定で結晶に変化しやすいのに対して、準結晶はもっと安定度が高く、簡単には結晶になりません。
金属結晶の大きな特徴の一つとして、簡単に曲げたり延ばしたりして変形できる、という性質があります。これは、金属結晶ではプラスに帯電した原子の集まりをマイナスに帯電した自由電子という変形自在の糊でつなぎ止めているという性格上、結合そのものに方向性がなく、原子どうしが位置関係を変えても問題が起きないことによります。(これに対して、共有結合性結晶では原子と原子が強く結び付いていますから、位置を変えるには一旦結合を切る必要があります。またイオン結合性結晶では、位置を変えることでプラスイオンとプラスイオン、マイナスイオンとマイナスイオンが直接に接する状態が現れ、安定ではいられなくなります。)さらに金属結晶の中には、原子一列が抜け落ちたり、列の並び方がズレたりする、転位と呼ばれる構造の乱れが多く含まれており、その転位の位置を順送りにズラして行くことで原子の互いの位置関係を変えるのが一層簡単になっているのです。ところが準結晶では、結晶ほどはっきりした規則性はありませんから、途中に欠陥があっても、それを順送りにズラすということがうまくできません。そのため同じ組成の結晶と比べて準結晶は硬く、変形しにくいのが普通です(アモルファス金属も同じ)。また、結晶金属では温度が高いほど電気抵抗が大きくなりますが、準結晶ではその逆で、半導体のように高温にするほど電気抵抗が下がるなど、いろいろと面白い性質があります。これから、準結晶を利用した実用製品が出てくるかもしれません。
雑科学ホーム
hr-inoueホーム










