
雑科学ホーム
hr-inoueホーム
● 電気分解の話 ●
水の電気分解の不思議
水の電気分解をやったことはありますか? 学校の理科の時間に実験した人も多いと思います。その時、水だけでは電流があまり流れないので硫酸ナトリウムなどの塩を溶かしたでしょう。これって不思議だと思いませんか? 電気分解をしている間、電子は負極で水酸化物イオンから抜かれて、正極で水素イオンに渡されるだけ。電流に関係しているのは水素イオンと水酸化物イオン、つまり水に由来する成分だけで、塩の成分はどこにも出てきません。なのに、塩を溶かさないと電流が流れず、水の分解も起こらない。これはなぜでしょう。「電流を多く流すため」では答えになっていません。電流がどんどん流れてそのうちに電気分解が起こるのではなくて、電気分解が起こって初めて電流が流れるのですから。
もう一つ、水の電気分解で特徴的なことは、その電圧と電流との関係です。オームの法則はご存知ですね。電圧と電流が比例する、というアレです。普通の導電体の場合はたいていオームの法則に従いますから、ちょっとでも電圧をかければ電流が流れ始め、電圧を2倍にすれば電流も2倍になります。ところが、水の電気分解では、少々電圧をかけても電流は流れません。普通、乾電池1個では無理です。そして、ある電圧を超えると、ようやく流れ始めます。そしてさらに電圧を上げると電流も増えますが、その増え方が直線的ではありません。その様子をグラフにすると図1のようになります。
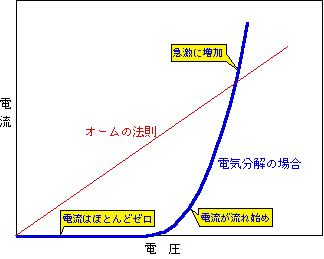
図1 水の電気分解時の電流と電圧の関係
このような性質は水の電気分解に限ったものではなく、液体に電極を浸して電気を流した時には、だいたいこうなります。つまり、電極反応の原理にかかわる基本的な現象なのです。ここでは水の電気分解を例に話を進めますが、他の水溶液や有機溶媒の溶液でも考え方は同じです。
ちょっと寄り道---カソードとアノード
ここで本題に入る前に、ちょっと寄り道をします。電池や電気分解に関する話の中で、「カソード」と「アノード」という言葉を聞いたことがあると思います。それぞれ英語の綴りでは「Cathode」と「Anode」で、英和辞典を引くと、たいてい「陰極」、「陽極」と書いてあります。しかし、この訳語は混乱を招く元凶になることがありますので、注意が必要です。もう一組の日本語、「正極」、「負極」というのが加わって、話がこんがらがってしまうのです。
正確に言うと、「電流(つまり正の電荷)が液から電極に入ってくる極がカソード」、「電流が電極から液に出てゆく極がアノード」です。そして、「相対的に電位の低い方の(電位が負の)極が負極」、「電位の高い方の(電位が正の)極が正極」です。「なんだ、陰極、陽極と同じではないか」と言われるかもしれません。確かに電気分解の場合はその通りで、「カソード」=「陰極」=「負極」、「アノード」=「陽極」=「正極」、という関係になります。ところが電池の場合はどうでしょう。電池の正極では外の回路へ電流が出て行きますが、この時の電池の内部を見ると、正極内部では液(乾電池といえども電池の中には電解液が入っています)から極へ電流が流れ込んでいるはずです。つまり電流の方向で言えば「カソード」になります。逆に負極では、外の回路を通ってきた電流が電極から電池内の液へと流れ出すので、電流の方向では「アノード」です。ですから電池の場合は「正極」が「カソード」で、「負極」が「アノード」ということになります。それでは、「陰極」、「陽極」という言い方ではどうなるでしょうか。「カソード」=「陰極」、「アノード」=「陽極」、という定義に従えば、電池では「正極」が「陰極」で、「負極」が「陽極」、ということになってしまいます。どうにも違和感がありますよね。だからと言って、一般的な感覚に従って、「正極」=「陽極」、「負極」=「陰極」、とやってしまうと、これまた「アノード」、「カソード」と「陽極」、「陰極」の関係が逆転してしまいます。実にややこしいですね。というわけで、電池の場合には、「陰極」、「陽極」という言葉は使わない方が、混乱を避けられるでしょう。「アノード」、「カソード」については、無理に訳さないで、そのまま「アノード」、「カソード」と呼んだ方が無難です。
ややこしついでに、もう少し。ものの本によっては、「電極での反応が還元反応である極がカソード」で、「酸化反応である極がアノード」、と書いてあります。カソードでは電流が液から電極に流れ込みますから、電子で言えば電極から液へ出て行きます。これは液の中の何者かに電子を与えることになる、つまり還元することになるのです。逆にアノードでは電子が液から電極に入りますから、液中の何者かから電子を引き抜く、つまり酸化することになります。(電池では、電子を与えたり引き抜いたりする対象が、液ではなくて電極そのものである場合も多いですが、やはり電極が還元される極が「カソード」で、電極が酸化される極が「アノード」になります)
ちなみに、カソード、アノードという言葉は液がないところでも使われます。よく出てくるのがテレビのブラウン管(最近減ってきていますが)。あの中に入っている電子銃の電子を発射する部分もカソードです。このタイプのディスプレイをCRTと呼びますが、この「C」はカソードの「C」です。電流の方向が、上の定義と合っていることはわかりますね。
いろいろと細かい話をしましたが、カソード、アノードの件はとりあえず頭の隅に入れておいてもらって、この稿では電気分解が主題ですから、「陰極」、「陽極」という呼び方で統一することにします。
電極反応の第一の壁
さて、ここからが本題です。水(水溶液)に電極を入れて電圧をかけると何が起こるでしょうか。まずは、陰極に正イオンが、陽極に負イオンが引き寄せられます。純粋な水の場合には、陰極には水素イオン、陽極には水酸化物イオンが来るでしょう。それでは水素イオンは、陰極からすんなりと電子を受け取るでしょうか。実はそうは行きません。陰極から出て行く電子が、ある一定以上のエネルギーを持っていなければ水素イオンは受け取ってくれないのです。ここで問題にしているのは電気的なエネルギー、つまり電位です。水素イオンが電子をやり取りする電位(酸化還元電位)よりも陰極のエネルギーが負に大きくならなければ、電極から水素イオンへの電子の移動は起こりません。同じように、正極の電位が水酸化物イオンの酸化還元電位(反応で作られるのは酸素ですから酸素の酸化還元電位)よりも正に大きくならなければ、水酸化物イオンは電極に対して電子を出しません。しかも陰極、陽極の両方でこの条件を満たさなければ電流は流れないのです。図2に、この電位の様子を示しました(一般的に電極反応は電子の流れで考えるので、負のエネルギーを上に取ります。この方が、電子の流れが上から下になって直感的に理解しやすいですから)。この酸化還元電位が、電極表面で反応が起こって電流が流れるための第1の壁です。図1の電流が全く流れない部分は、この第1の壁を登っている段階なのです。
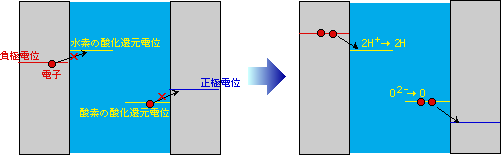
図2 電極反応が起こるための条件
ところで、電位を正にする、負にする、と言いますが、具体的にはどうするのでしょうか。実験的に電極間にかけるのは電圧、つまり電位の差であって、電位そのものではありませんよね。例えば、どんなに電圧をかけても、一方の電極の電位が酸化還元電位を超えなければ電流は流れないのでしょうか・・・。実はそんな心配は無用です。その理由を説明しましょう。
図3を見てください。初めは左端のように、電極の電位は水素の酸化還元電位と酸素の酸化還元電位の間にあります。ここに電圧をかけると、陰極には負の電荷(電子)が、陽極には(電子が抜けた後の)正の電荷がたまり、電圧に相当する分だけ電極の電位が上下に分かれて行きます。電圧を徐々に上げて行って、仮に陰極の電位が先に水素の酸化還元電位に到達したとしましょう。ここからさらに電圧を上げても、陰極では電子が水素イオンに移りますから電子はそれ以上溜まらず、電位は上がりません。一方陽極はまだまだ電荷を溜めることができますから、増加した電圧分はすべて陽極の電位変化に費やされます。その結果、陽極の電位は急降下し、やがて酸素の酸化還元電位に届くと、全体を通じて電流が流れるようになります。このように、仮に一方の電極電位が酸化還元電位に先に達しても、そこで足踏みしてくれますから、その間にもう一方の電極が追いつけるのです。実際には電極を水につけた時点で電極電位は両方の酸化還元電位の中間あたりに来ますから、図3のような極端な形にはならず、両方の極の電位はほぼ同時に酸化還元電位に到達します。
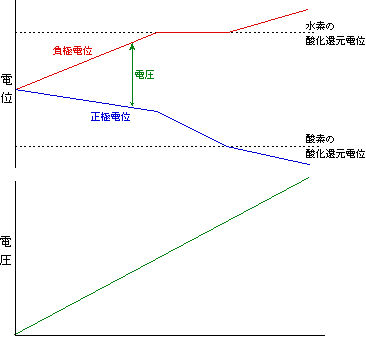
図3 電気分解時の両極の電位の変化
電極反応の第二の壁
電極電位が酸化還元電位を超えた時点で何の障害もなく電流が流れるのであれば、電流は電圧に対して直線的に変化してもよさそうですが、現実にはそうはなりません。ここに第2の壁、活性化エネルギーがあるからです。図4に、陰極の場合の壁の様子を示しました。電極部分と水部分のエネルギーだけを見れば電子は左から右に行けるのですが、間に高いエネルギーの山があって簡単には超えられません。まずはこの山を越えて電子が移動できなければ、水中の物質を還元することはできないのです。

図4 電極反応の活性化エネルギー
活性化エネルギーは電極反応に限らず、ほとんどの化学反応に存在します。その原因は、反応の途中でエネルギーの大きい中間物ができるとか、電子などが飛び出すのに勢いが必要だとか、いろいろです。もし活性化エネルギーがなかったら大変なことになります。全てのものが、エネルギーの低い状態に簡単に移ってしまうのですから、水と酸素は混ざっただけで水になってしまいますし、私たちの体を作っているたんぱく質も脂肪も炭水化物も、みんな酸素に触れただけで燃えてしまうでしょう。活性化エネルギーがあるおかげで、高いエネルギーの状態でも安定でいられるのです。
それはさておき、電極反応ではどうすればこの活性化エネルギーの山を超えられるでしょうか。答えは「電位をもっと上げる」です。電極の電位を上げる(陰極の場合は負に大きくする)と、図5のように山の形が変わり、電極側から見ると山が低くなるのです。山が低くなると、それを超えることができる電子の数は指数関数的に急増しますから、電流も指数関数的に増えて行き、図1のような曲線になるのです。このように、酸化還元電位を超えて余分に加える電圧のことを過電圧と呼んでいます。実際の電気分解での過電圧は、陰極と陽極の両方の過電圧の合さったもの、ということになります。
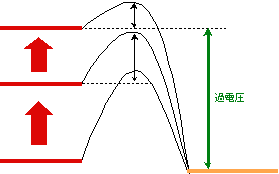
図5 活性化エネルギーに対する過電圧の効果
過電圧の値、つまり活性化エネルギーの山の高さは、電極の種類やその表面の状態によっても変化します。大雑把に言って、同じ材質ならば表面が凸凹しているほど過電圧は小さくなる傾向があります。液の電導度を測定する時に使う電導度計の電極などには、白金黒といって、普通の白金の上に微細な粉状の白金を付けたものが使われますが、これは、ただでさえ小さい白金の過電圧をさらに小さくする工夫です。
水の中の電位
電極と水との間の関係については、少々乱暴な記述もありますが、一通り見てきました。でも、もう一つ問題があります。それは2つの電極の間、水中の電位の状態です。両極間に電圧がかかっている状態で、その間の水の電位はどうなっているのでしょう。もしも電極間に何もなかったら、その間の電位は図6aのように、陰極電位から陽極電位まで直線的に変わります。ここに水を入れると、水の中の正イオンが陰極に、負イオンが陽極に引き寄せられます。陰極の表面に集まった正イオンは、その正電荷で、陰極に溜まった負電荷を一部隠してしまいますから、陰極付近の電位は正イオンの分だけ下がります。陽極側も同様で、その結果、電位は図6bのようになります。水中のイオンの量がもっと多ければ電位は図6cのようにまっ平らになります。これは、もうほとんど金属と同じ状態です。
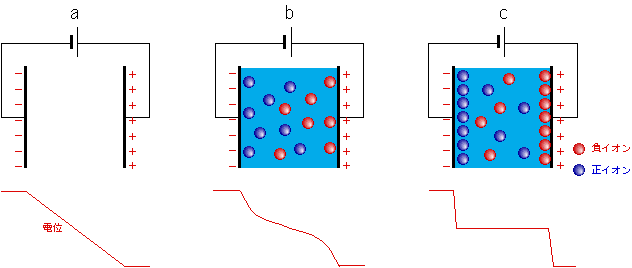
図6 電極間の電位
純粋な水の場合、その中の水素イオンや水酸化物イオンの量は微々たるものですから、この効果は実は大したことはなく、ほとんど図6aに近いと言ってよいでしょう。ここで、先ほどの電極反応の第2の壁の話を思い出してください。水素イオンや水酸化物イオンが反応するには、電極の電位を充分に高くして電荷を水側に移動させることが必要でした。この時、水の側の電位は変わらないという前提だったのですが・・・、実際には図6aのように電極電位に引きずられて一緒に上がってしまうのです。こうなると電極と水の間には充分な電圧がかかりませんから、電荷は移動できません。両極の真中あたりでは水の電位は変わっていませんが、こんな遠くまで電荷が裸で飛んで行くことは不可能です。やはり電極のすぐ近くの電位が重要なのです。
ここで最初の疑問に出てきた硫酸ナトリウムの登場です。このような塩を多量に溶かすことで、水中の電位が図6cの形になるのです。こうなると、外から加えた電圧が電極近くのごく狭い部分に集中しますから、電荷は低くなった山を楽々と越えて水側に移り、効率よく電極反応が進むのです。最初の疑問がようやく解けました。水の電気分解ひとつをとってみても、奥が深いのです。
雑科学ホーム
hr-inoueホーム






