
雑科学ホーム
hr-inoueホーム
● 湿式太陽電池の話 ●
誰でも知っている太陽電池
今の時代、「太陽電池」という言葉を聞いたことのない人はいないでしょう(少なくともこのページを見ているような人では)。電卓やら公園の電灯やらで普通に目にすることができますし、屋根に太陽電池パネルを載せた家も多くなりました。テレビのコマーシャルでもしょっちゅうやってますね。新幹線で岐阜羽島あたりを通ると、太陽電池で覆われた某電機メーカーの巨大な建物も目に付きます。これらのほとんどはアモルファスシリコンでできた太陽電池です。比較的安価に、大面積の電池が作れるからです。一方で、値段に糸目はつけないから性能がよければ、という場合には、結晶のシリコンやガリウム砒素の太陽電池が使われています。ソーラーカーレースで優勝を狙うような場合や、人工衛星用の電源などがそうです。
この手の太陽電池の構造や原理については、世の中に立派な解説書がたくさんありますし、「
半導体の話」のところでも少し書きましたから、ここではあまり触れないことにして、ちょっと変り種の「湿式太陽電池」の話をすることにします。最近、結構注目されていますから、知っている人も多いと思いますが。
歴史は以外に古い「湿式太陽電池」
最近注目を集めている「湿式太陽電池」ですが、歴史は結構古いのです。発端は1971年の本多、藤嶋両先生による水の光分解の発見です。酸化チタンの結晶を白金対極とつないで水溶液中で光照射すると、電気が流れて水が分解するというもので、太陽光によって電気エネルギーと化学エネルギー(水素のことです)とを両方取り出せる技術として注目されました。特に当時は、人工の光合成に近いプロセスとして、水素の発生に対する関心が高かったようです。分解の対象は水に限らず、有機物も分解して水素を出す、ということで、ゴキブリの体から水素がブクブク出ている映像を見た記憶があります。
ところが、燃料として使える量の水素を発生させるのはとんでもなく大変であることがわかってきました。例えば、1平方メートルの電極を使ってボンベ1本分の水素を貯めるのに何ヶ月もかかってしまうのです。そのため、水素発生に代わって有機物を分解するという用途が注目を集めます。光触媒です。こちらの用途では、必ずしも平面の電極を作る必要はなく、酸化チタンの粉末でも機能が出ますので、塗料にして壁に塗るなどの使い方がいろいろ考えられました。トイレの壁やら車の塗装、家の外壁など、あちこちで使われています。
そんな中、1991年にとんでもない発表がありました。酸化チタン粉末に色素を付けた電極で、何と効率10%を超える光電池ができたというのです。湿式光電池の効率は1%そこらが普通でしたから、これは驚異的な数字です。発表したスイスのグレッツェル教授は俄かに時の人となりました。色素を使って感度を高める方法は70年代からありましたから、何が効いてこんな数字が出たのか、ずいぶん議論されたようです。特に、同じやり方で作っても誰も同じ結果を出せなかったことで、ちょっとしたミステリーになっていました。その後、あちこちで研究が続けられて、そこそこの効率が出るようになりましたから、一応は高効率の光電池としての地位は固まっているようです。
溶液に浸した金属
太陽電池の原理を説明する前に、準備運動として、金属電極を溶液に浸した時にどのようなことが起こっているかを見ておきましょう。この場合の溶液には、電子を他から引き抜くことができる酸化型の成分と、他に電子を与えることができる還元型の成分のペア(酸化還元対)が溶け込んでいるとします。酸化型成分は他から電子を引き抜いて取り込むことで、自身は還元型に変化し、逆に還元型成分は他に電子を与えることで自身は酸化型に変化します。要するに、電子を出したり入れたりすることで、酸化型と還元型の間を行ったり来たりするのです。それでは酸化還元対はどんな時に電子を出し、どんな時に電子をもらうのでしょうか。それは電子のエネルギーレベルで決まります。酸化還元対が持っている電子のエネルギーレベル(酸化還元電位)よりも高い(電子のエネルギーですから、負に大きい)エネルギーレベルの物質が相手ですと、その相手から酸化型成分が電子を受け取ります。一方、酸化還元電位よりも低いエネルギーレベルの物質が相手の場合は、還元型成分が相手に電子を与えます。酸化型成分と還元型成分が同じ量含まれている場合の酸化還元電位を、その対の標準酸化還元電位と言い、物質によって決まっています。酸化型成分が多くなると酸化還元電位は低くなり、還元型成分が多くなると高くなります。代表的な酸化還元対としては、2価の鉄イオンと3価の鉄イオンのペアや、写真の現像液の主成分であるヒドロキノンとその酸化型であるキノンのペアなどがあります。
次に、相手の金属について見てみましょう。金属にも酸化還元対の場合と同じような電位があります。もちろんこれは金属中の電子のエネルギーを表しているわけで、アルミニウムや亜鉛などは比較的高い(負に大きい)電位を持っており、金や白金などの貴金属は低い電位を持っています。金属の場合、この電位のことをフェルミレベルと呼びますが、溶液の酸化還元電位と同じ意味を持つものと考えてよいでしょう。金属を水槽に、その中の電子を水にたとえると、フェルミレベルは水槽中の水面、というところです。
さて、この金属を酸化還元対を溶かした溶液に浸したとします。その時、金属のフェルミレベルよりも溶液の酸化還元電位が低かったとしましょう。電子は金属から溶液に移動し、酸化型成分を還元します。その結果、金属中にはマイナス電荷が不足して電位がプラスに偏り、逆に溶液はマイナスに偏って、図1のように金属のフェルミレベルと溶液の酸化還元電位が一致したところで電子の移動が止まります。この時、金属の方は電子が少し抜けただけで大きくプラスに偏りますが、溶液の方は酸化型成分と還元型成分が十分にあれば酸化還元電位はほとんど動かないのが普通です。図1の右の状態で、フェルミレベルは一致していますが、電位は金属と溶液とで違っていることに注意してください。普通、電位の差があると電流が流れる(つまり電子が移動する)のですが、このように異なる物が接触する場合には、電子の動きを支配するのはフェルミレベル(あるいは酸化還元電位)であって、電位ではないのです。
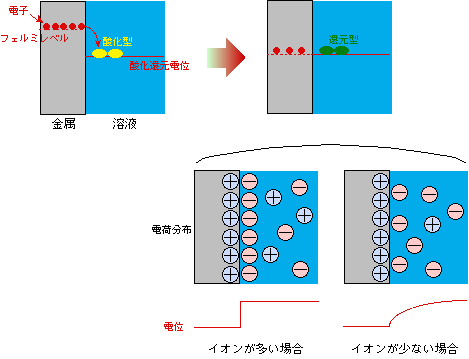
図1 金属と溶液の接触
それぞれの物質に残ったプラス電荷とマイナス電荷はお互いに引き合いますから、金属中のプラス電荷(電子の抜け孔)と溶液中のマイナス電荷(負イオン)は、それぞれ図1左下のように界面に集まります。この時、金属の奥の方から界面を見ると、金属側のプラス電荷が溶液側のマイナス電荷を完全に打ち消していますから、金属内部だけを考えれば、電位の差は生じていません(何事もなかったかのようにまっ平らです)。溶液の方も、イオンの量が充分に多ければ金属と同じ状態になりますが、もしイオンの量が充分でなければ、界面に集まったイオンだけでは金属側のプラス電荷を打ち消せないので、少し沖合いにも影響が及んで、電位は平らになりません(図1右下)。
半導体を溶液に浸すと
それでは、先ほどの金属を半導体に置き換えてみましょう。「
半導体の話」の項でも説明しているように、半導体には電子が詰まって動けなくなっている価電子帯と電子が存在できないエネルギー領域である禁制帯、さらにその上にほぼ空の伝導帯があります(エネルギーバンドと呼びます)。n型半導体では伝導帯の近くに不純物が作るドナーレベルというエネルギー準位があり、ここの電子が伝導体に移って、いくらか電流が流れる状態になっています。この時、半導体の電子のエネルギーを表すフェルミレベルは伝導帯の底あたりにあります。
この半導体を、そのフェルミレベルよりも低い酸化還元電位を持った溶液に浸すと、半導体から溶液への電子の移動が起こり、フェルミレベルと酸化還元電位が同じ高さになります。溶液側の状態は、先ほどの金属を浸した場合と変わりありません。一方半導体側はというと、半導体内部で電子が不足して電位がプラスに偏るところまでは同じですが、ここからが少し違います。移動して行った電子は元はと言えばドナーレベルにあったもので、そのドナーレベルは半導体の中にパラパラと撒かれていますから、金属のようにプラス電荷が界面に集まることができないのです。その結果、半導体の電位は界面から内部に向かってパラパラと下がって行き、図2に示したようにエネルギーバンドが曲がることになります。これは半導体のp−n接合のn型部分を切り出した形であり(「
半導体の話」参照)、またイオンが不足した時の溶液の状態(図1)にもよく似ています。

図2 半導体と溶液の接触
溶液の酸化還元電位が半導体のフェルミレベルよりも高い場合には、電子は溶液から半導体の伝導帯に入ります。この場合には半導体に入った電子は自由に動けますから、半導体は金属的に振る舞い、半導体独特の性質は現れません。つまり太陽電池にはならない、ということになります。
太陽電池の動作
ようやく準備が整いましたので、ここで溶液に浸した半導体に光を当ててみます(図3)。すると、価電子帯の電子が伝導帯に飛び上がり(励起と言います)、励起された電子はバンドが曲がった斜面に沿って半導体の内部へと転がり落ち、また価電子帯に残った抜け孔(正孔)は界面へと転がり上がります(変な表現ですが、負のエネルギーを上にとっているので仕方ありません)。奥へ入った電子はそこで行き止まりになりますから、次々と励起された電子は、奥の方にどんどん溜まって行きます。一方で界面に来た正孔は、エネルギーが充分低いですから、溶液中の還元型成分から電子を引き抜いて消滅します。その結果、半導体の奥の方は次第にマイナスに偏って電位が上がってきますので、バンドの曲がりは小さくなります。バンドの曲がりが小さくなると、励起された電子が勢いよく転がらなくなって元の場所でウロウロし始めますから、真下(エネルギー的には真下ですが、空間的には同じ場所)の正孔に落ち込む(再結合する)確率が高くなってきて、やがて励起のスピードと再結合のスピードがつり合ったところで安定します。もし照射する光が充分に強ければ、最終的にはバンドの曲がりが完全になくなります。この時の状態をよく見ると、半導体と溶液の間で電子の移動が起きる前の状態(図2の初めの状態)と同じであることがわかりますね。
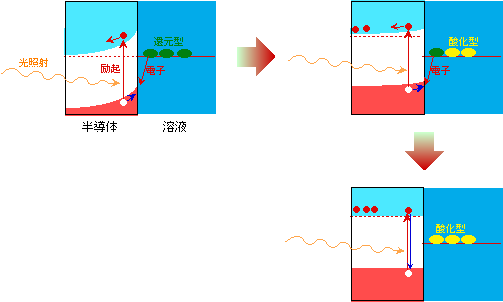
図3 溶液中の半導体への光照射
ここで同じ液の中に別の金属電極(対極と呼びます)を浸して湿式太陽電池の構成にし、半導体と金属の間の電圧を計ってみましょう(図4)。測定される電圧は電子を流そうとする力であり、それはフェルミレベルで決まる、とういうことは既に説明しました。金属対極のフェルミレベルは液の酸化還元電位と同じになっていますから、半導体電極と金属対極の間の電圧は、半導体と金属のフェルミレベルの差、ということになります。これは図からわかるように、元々の半導体のフェルミレベルと液の酸化還元電位の差になるのです。これが、この湿式太陽電池の出すことができる最大電圧(起電力)で、開放電圧と呼びます。(「開放」とは、「回路がつながっておらず開いている」という意味です。図4では電圧計でつながっているように見えますが、電圧計は理想的には抵抗無限大、つまり電流は流しませんから、これで「開放」状態です。)
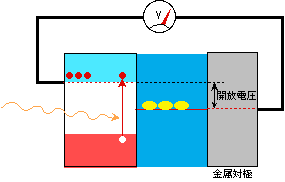
図4 開放状態の湿式太陽電池
次に、半導体と金属対極とを電流計でつないでみましょう(図5)。電流計は理想的には抵抗ゼロ、つまり2つの電極を短絡した状態になります。短絡すると電子は当然フェルミレベルの高い方から低い方へと流れますから、半導体に溜まっていた電子は電流計を通って対極へ入り、ここで溶液中の酸化型成分に移ります。溜まっている電子が一掃され、新しく励起される電子もどんどん出て行きますから、半導体のフェルミレベルは光を当てる前の状態に戻っています。この時の電流を短絡電流といいます。短絡電流は、理屈の上では、光を強くすればいくらでも大きくすることができるはずですが、現実にはいろいろな要因で、無限に大きくなるということはありません。
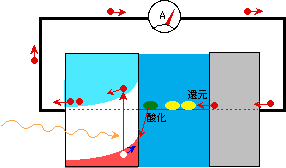
図5 短絡状態の湿式太陽電池
実際に太陽電池が働いている時の状態は、図4と図5の中間になっているのが普通です。ここで電流が流れている時の電子の動きを確認しておきましょう。電子の旅は価電子帯から始まります。光を吸収すると価電子帯から伝導帯に飛び上がり、坂を転がって外に出て行きます。外の回路を通って金属対極に入り、液の酸化型成分に移り、還元型に変化させます。還元型成分が液中を漂って半導体電極の表面に到達すると、電子は価電子帯の中に残っていた正孔に飛び移り、完全に1周して元の状態に戻ります。液の中を見ても、対極で酸化型成分が還元型に変わり、半導体電極で還元型成分が酸化型に変わりますから、結局は全く変化しないのです。つまり、このタイプの太陽電池は、原理的には永久に使える、ということになります。
電池の構成によっては、電流を流すと元の状態に戻らない場合もあります。例えば、初めに書いた水の光分解をする電池がそうです。この電池では、対極に移動した電子が液中の水素イオンに与えられますから、水素イオンは水素ガスとなって外に出てしまうのです。一方半導体電極では、電子を多く持った物質が何らかの酸化反応を受けることで電荷のバランスをとっています。その物質が水酸化物イオンであれば酸素が発生しますし、有機物であれば分解されます。
また、これはありがたくないケースですが。半導体電極で他の物質が酸化される代わりに、半導体自身が分解される場合もあります。実は大部分の半導体は水溶液中で表面に集まった正孔のために酸化されて、液中に溶け出してしまうのです。そのため、湿式太陽電池に使える半導体はごく限られており、ほとんど酸化チタンのみ、一部で酸化亜鉛が使われる程度です。
効率アップの決め手---色素
水溶液中での安定性で随一の酸化チタンですが、泣き所がひとつあります。それは価電子帯と伝導帯のエネルギー差、バンドギャップが大きいということです。半導体が光を吸収する時には、電子がこのバンドギャップを越えて飛び上がらなければなりませんが、バンドギャップが大きいと、それだけエネルギーの大きい(波長の短い)光が必要になる、ということです。酸化チタンの場合には、光の波長が380nm以下の紫外線でなければ吸収できません。ところが太陽光の大部分は人間の目に見える400nm〜800nmの可視光線で(太陽光の中で大部分を占めるこの領域の光が見えるように生物の目が進化した、と言った方が正しいのでしょうが)、紫外線はたった4%に過ぎません。これでは、酸化チタンの太陽電池はどんなにがんばっても4%以上の効率は出せない、ということになってしまいます。
ここで登場するのが、色素増感という考え方です。色素というからには色を持っている、色を持っているということは可視光を吸収する、ということです。そして色素の中での光の吸収は、半導体と同じように、電子が低いエネルギーから高いエネルギーに励起することで起こります。それならば色素を半導体の代わりに使えばよい、ということになりそうですが、残念ながらそうはいきません。色素の内部には半導体のようなバンドの曲がりはできないので、せっかく励起した電子を転がして外に運び出すことができないのです。そこで、可視光の吸収だけを色素に担当させて、励起した電子をすぐに半導体に渡してやればよい、という考え方が出てきました。これが色素増感です。グレッツェルの太陽電池もこの色素増感型の一種です。
色素増感太陽電池の原理を簡単に示したのが図6です。色素がまず光を吸収し、半導体の伝導帯に電子を移します。その後の電子の旅路は、色素なしの太陽電池とほとんど変わりません。ひとつだけ違っているのは、最後に液中の還元型成分から電子をもらうのが、半導体の価電子帯ではなく、色素の空のエネルギーレベルであるということですが、元々電子はここから出発しているのですから当然ですね。
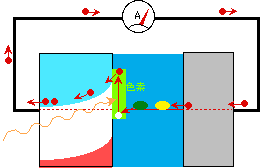
図6 色素増感湿式太陽電池
実際の色素増感太陽電池の構造
効率よく動く太陽電池を組み立てようとすれば、いろいろと材料や構成を考えなければなりません。実際によく使われる湿式太陽電池の概略を図7に示しておきました。
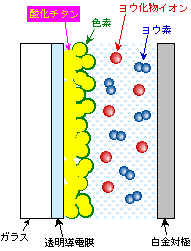
図7 実際の色素増感太陽電池の構成
透明な導電膜の上に酸化チタンの微粒子でできた層を乗せ、その酸化チタン微粒子の表面に色素を吸着させています。こうすることで表面積を大きくして効率を高めているわけです。色素としてはルテニウム系を中心にいろいろ試されているようですが、とりあえず動けばよいということであれば、花から絞った色素などでも大丈夫のようです。液中の酸化還元対としてはヨウ素とヨウ化物イオンの組み合わせが使われますが、これは簡単にはヨウ化カリウムの水溶液にヨウ素を溶かすことで作られます。学校の理科の時間に、デンプンの検出のためにヨウ素液を使ったことのある人も多いでしょう。あのヨウ素液と同じ物です。ヨウ素が酸化型でヨウ化物イオンが還元型です。対極は白金が使われるのが普通です。もっと安い金属を使いたいところですが、白金以外ではどうも溶液との電子の受け渡しがうまくいかないようです。ただし、むくの白金板はとんでもなく高いので、導電性ガラスなどに白金の薄膜を付けたものが使われています。このような構成で、酸化チタンの作り方や色素の選び方、材料の純度などをいろいろと検討して、効率を高める努力が為されています。
湿式太陽電池は本当に使えるのか
今のところ何とも言えない、というのがこの問いに対する答えです。確かに安上がりだし効率もそこそこ。使える要素はあります。しかし一方で、長期間使っていると色素が分解する、とか、液体を使うので液漏れが心配、とか、いろいろな問題点も指摘されています。液漏れは技術的に何とかなる(封止技術の改良や電解質の固体化など)として、色素の分解はやっかいですね。使用環境を制限すれば、かなりの寿命はあると聞いていますが・・・。
いずれにしても、今後の動向に注目しましょう。
雑科学ホーム
hr-inoueホーム







