
目 次
雑科学ホーム
hr-inoueホーム
結 果
1. 収着熱およびエントロピー
図3に水素(n-H2)の収着等温線を示す。等量収着熱 qstは、θ = 0.2〜0.5 の範囲で90℃処理のものが2.2kcal/mol、300℃処理のものが2.5kcal/molとなった。ここで被覆率の値は、Langmuir式から得た単分子容量 Vmより求めたもので、図4にそのLangmuir plotを示す。
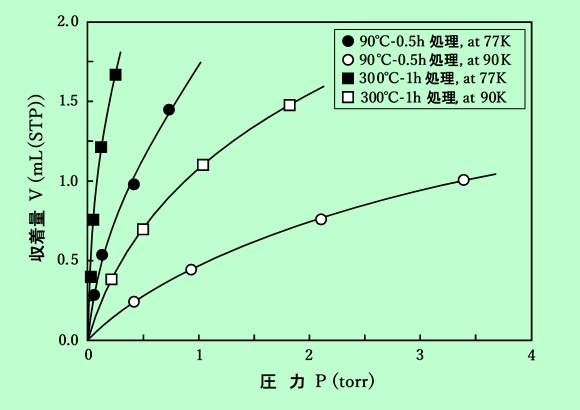
図3 モルデナイトによる水素の収着等温線
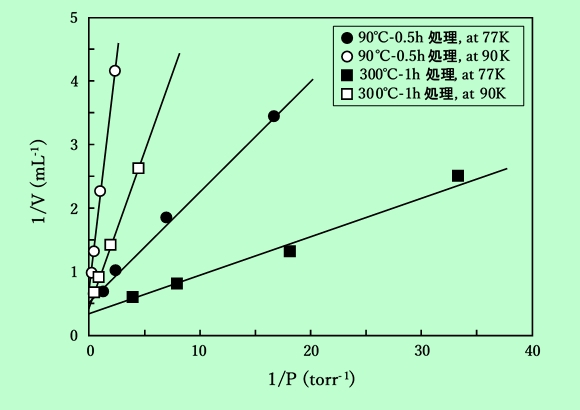
図4 水素収着のLangmuirプロット
収着熱から、次の式で熱エントロピーが計算できる15)。
Stherm = Sst(gas) + R ln { 760 / Peq} - qst / T
ここで Sst(gas) はJANAF Interim Thermochemical Tablesによる値をもとに計算した気相での標準エントロピー、R は気体定数、Peq は平衡圧、T は温度である。水素がモルデナイト細孔中の一ケ所に留まっている場合、振動のエントロピーが77〜90Kのような低温では極めて小さいことを考慮すると、Stherm は回転エントロピー Srot に等しくなるはずである。しかし、Srot を実際に計算すると2〜3cal/mol/Kしかなく、表Iに示すように10〜12cal/mol/Kである Stherm と比べてかなり小さい。一方、細孔中の水素を一次元ガスと考えて、その並進エントロピーを
Strans(one-dim) = 1.5 R + 0.5 R ln (2π m k T / h 2) + R ln {L / Vm}
(m は吸着分子の質量、k はボルツマン定数、h はプランク定数、Lは単位重量当たりの細孔長)に従って計算すると13),16)、8cal/mol/K前後の値が得られる。これに Srot を加えると Stherm にほぼ等しくなることから、水素分子はモルデナイト細孔中を一次元的に運動しているものと考えられる。
表I 水素の収着熱およびエントロピー
| 熱処理 |
単分子容量
Vm
(mLSTP) |
等量収着熱
qst
(kcal/mol・K) |
熱エントロピー |
一次元エントロピー |
| 77K |
90K |
77K |
90K |
| 90℃, 0.5h |
19±2 |
2.2±0.2 |
11.3 |
12.2 |
8.1 |
8.3 |
| 300℃, 1h |
25±2 |
2.5±0.1 |
10.0 |
10.7 |
7.6 |
7.7 |
2. 収着分離係数
ナトリウムモルデナイトは、p-H2⇔o-H2 変換反応の触媒として働く。これは収着分離係数の決定を行なうには不都合なことであるので、この触媒能について検討しておく必要がある。また、o-H2とp-H2の収着親和力の違いをはっきりさせる意味も含めて、種々の条件で処理したナトリウムモルデナイトにn-H2とp-r-H2を接触させて、その圧力変化を時間の関数として追ってみた(図5(a),(b))。ここには圧力を収着量に直した値も同時に示している。
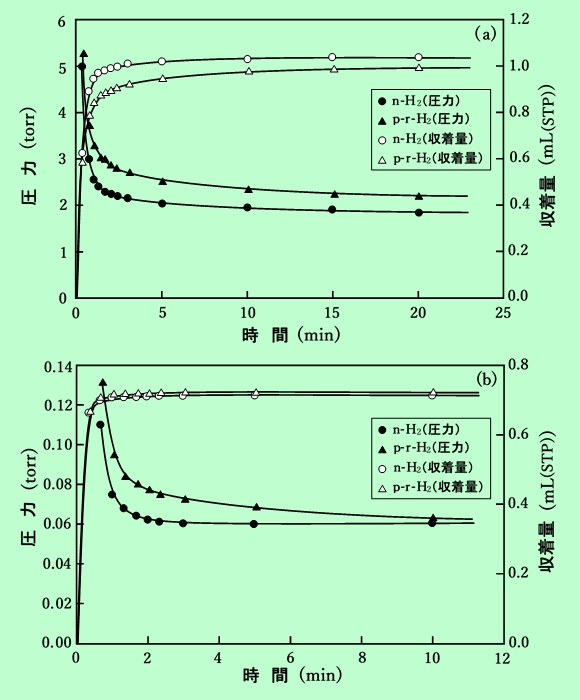
図5 モルデナイトに接触させた水素の圧力、収着量変化
(a) 90℃-0.5h処理モルデナイト
(b) 300℃-1h処理モルデナイト
これを見ると、いずれの処理条件に於いてもn-H2、即ちo-H2を多く含むものの方が速く収着されており、o-H2の収着力がp-H2のそれよりも強いことが裏付けられた。しかしこの差が時間の経過と共にしだいに小さくなって行くこと、及び処理条件が強いほど2種類の水素の差が小さいことから、p-H2⇔o-H2の変換が起こっていることが推察される。
この点を確認するために、90℃で30分間処理したナトリウムモルデナイトにn-H2及びp-r-H2を接触させて、組成が変化する様子をガスクロマトグラフで追ってみると、図6のような結果が得られた。
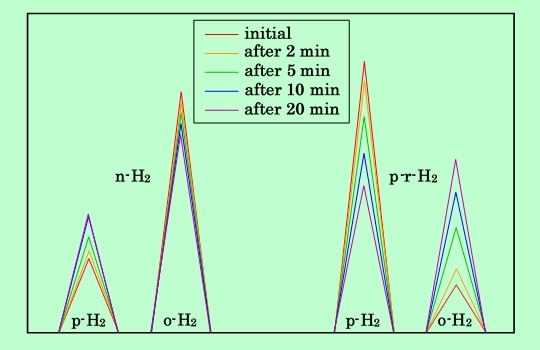
図6 モルデナイトとの接触による水素の組成変化の模式図
いずれも接触後20分を過ぎると、p-H2とo-H2の比は、この実験を行なった77Kでの平衡値である1:1という値に近くなっている。この2つの実験の結果から、(1)p-H2とo-H2の変換がほとんど起こっていないこと、(2)p-H2とo-H2の収着量に充分差が生じていること、(3)収着平衡もしくはそれにごく近い状態に達していること、の3点を考慮して、収着分離係数の測定は90℃、30分間処理のナトリウムモルデナイトを用い、水素を導入してから2分経過した後の組成を分析して行なうことにした。
水素の組成の分析を行なう場合、導入した水素と2分後の気相の水素は直接分析できるが、収着相については、脱離させたものを測定するとその間にも p-H2⇔o-H2 の反応は進んでいるために、よい結果は得られない。そのため収着相については直接の測定は行なわず、導入した水素と気相の水素の分析結果から計算によって組成を求めた。測定結果を表IIに示す。この表には300℃処理のモルデナイトについての値も示してあるが、この場合は p-H2⇔o-H2 の反応が速いために、気相のp-H2の方が導入した水素中のp-H2の割合よりも減少して、収着分離係数が1よりも見かけ上小さくなってしまう。90℃処理のものについてはこのような問題はなく、収着分離係数として77Kで1.44、90Kで1.30という値を得た。
表II 収着分離係数の決定に関するデータ
処理温度
(℃) |
収着温度
(℃) |
導入水素 |
接触時間
(min) |
気相水素 |
収着相水素 |
収着分離係数 |
| 量(mL) |
p/o比 |
圧力(torr) |
量(mL) |
p/o比 |
量(mL) |
p/o比 |
| 90 |
77 |
6.50 |
1.12 |
2 |
22.0 |
3.14 |
1.35 |
3.36 |
0.94 |
1.44 |
| 90 |
90 |
5.94 |
2.38 |
2 |
27.7 |
3.65 |
2.64 |
2.29 |
2.03 |
1.30 |
| 300 |
77 |
9.5 |
2.38 |
2 |
22.2 |
3.0 |
2.00 |
6.5 |
1.80 |
- |
| 300 |
77 |
9.5 |
2.38 |
5 |
23.1 |
3.1 |
1.96 |
6.4 |
1.29 |
- |
| 300 |
77 |
9.5 |
2.38 |
15 |
22.4 |
3.0 |
1.06 |
6.5 |
0.86 |
- |
| 300 |
77 |
25.0 |
0.33 |
5 |
56.7 |
7.6 |
0.76 |
17.4 |
0.77 |
- |
(収着相水素に関して、前処理90℃のデータは、導入水素と気相水素の値から計算したもので、
前処理300℃のデータは、収着相を脱離させて測定したもの)
目 次
雑科学ホーム
hr-inoueホーム





