
雑科学ホーム
hr-inoueホーム
● 電池の話(その2) ●
電池の電気は高価
電池の便利さは今さら言うまでもありませんが、その電気のコストはいくらぐらいか考えたことはありますか? 例えば最も安価なマンガン電池の場合、単三タイプで安い店では1個10〜20円ぐらいで売られています。電圧は1.5Vで容量は700mAhぐらいですから、電力としては1Wh程度になります。つまり1Whあたり10〜20円、1kWhあたり10000〜20000円ということになります。これに対して家庭のコンセントに来ている電気の料金は、基本料金は別にして1kWhあたり20円ぐらいですから、電池の電気代はその500〜1000倍。家で携帯ゲーム機などを電池で使っていると、コンセントから電気を取った時の1000倍ものお金がかかるのです。もちろん携帯性や機動性の値段と思えば必ずしも高くはないのかもしれませんが、それにしても1000倍とは・・・・・。
そこで、充電できる二次電池や燃料を供給すればいつまでも使える(?)燃料電池の登場です。この稿では
電池の話(その1)に続いて、これらの電池について見て行きます。
二次電池の基本は“双方向”
外から電圧をかけて放電とは逆の方向に電流を流すことで全く逆方向の反応が起こり、内部の状態が元に戻るタイプの電池が二次電池です。その一般的な形を図1に示しました。ただし、ここでの正極、負極というのは、電極そのものだけでなく電解液も含めた正極/負極の反応系を表していると考えてください。
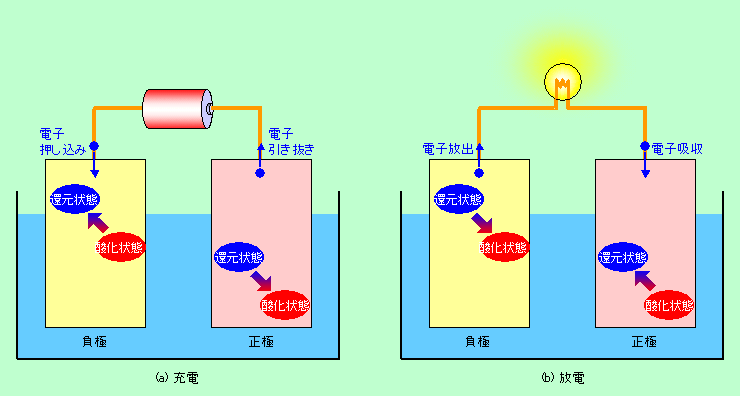
図1 二次電池の充放電の一般形
充電では負極に電子を押し込んで電極物質を還元し、正極からは電子を引き抜いて電極物質を酸化します。ですから充電反応では、電気分解と同様に、負極がカソードで正極がアノードです(
電気分解の話参照)。逆に放電では負極物質が酸化されて電子を外の回路に放出し、正極物質は電子を外から受け取って還元されますから、負極がアノード、正極がカソードとなるわけです。重要なのは充電と放電で完全に逆向きの反応が起こるということで、少しでも違う反応が起こるとその度に電池の状態が変わってしまいますから、いずれサイクルが破綻することになるのです。
電池の話(その1)で一次電池の充電について触れましたが、これなどは元々なかった物ができるわけですから、本来の二次電池とは全く別物です。また充電可能な二次電池でも、充放電を繰り返すうちに少しづつ元に戻れない変化が蓄積して、最終的には寿命が来るのです。
二次電池いろいろ
それでは、具体的に二次電池の実際を見てみましょう。
鉛蓄電池
二次電池の代表格と言えば、やはり何と言っても鉛蓄電池です。鉛と酸化鉛の電極を硫酸に浸した簡単な構造のこの電池については詳しい説明は不要でしょう。とりあえず概略だけを図1に示しておきます。
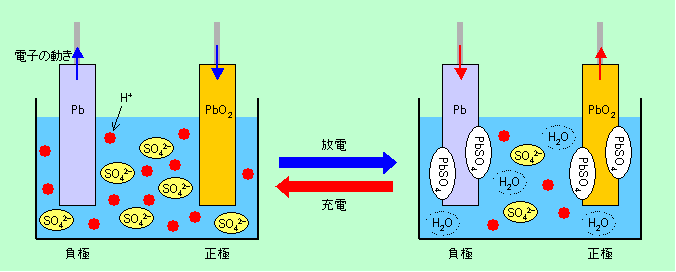
図2 二次電池の代表、鉛蓄電池
鉛蓄電池は値段が安く、電池としての特性も非常に優れているのですが、電極が鉛とその酸化物ですからとにかく重いですし、電解液に硫酸を使うので、手軽に使うというわけには行きません。それでもこれに代わる価格と性能を持った電池が他にありませんから、今でも車のバッテリーなどに大量に使われています。
ニッケルカドミウム電池
負極としてカドミウム、正極としてニッケルの酸化物、電解液にアルカリ水溶液を使う電池です。乾電池タイプの充電可能電池として最初に一般に売り出されたもので、普通の乾電池とニッケルカドミウム電池の着ぐるみを着た人が縄跳びで競争するコマーシャルを覚えている人もいるかもしれません。円筒型のものは、正極、負極それぞれの材料粉末を金属の網などの上に成型して薄い帯状にし、両極を分離するセパレーターを間に挟んでくるくる巻いて容器に詰め込むのが普通です。電圧は1.2Vと低めですが、内部抵抗がマンガン電池と比べて2桁程度も小さく、放電中の電圧も安定しているので、通常の1.5V電池の代わりに電気製品に入れてもほとんどの場合は問題なく働きます。むしろ大電流の用途にはマンガン電池よりもパワーが出るくらいです。ただしこの電池は、放電が完了しないうちに次の充電をしていると、そこまでの放電しかできなくなってしまう(まだ余力があるにもかかわらず、電圧が下がり始める)というメモリー効果があります。甘やかしているとサボリ癖がつくというわけです。この癖を直すには、一度徹底的に働かせてエネルギーを搾り取らなければなりません。もう一つの問題点は、負極に使うカドミウムが有害物質として指定されていることです。世界的に使用を規制する動きが広がっていますから、水銀電池の製造が中止になったのと同様に、今後も大量に作り続けるというのは難しいでしょう。
ニッケル水素電池
ニッケルカドミウム電池に代わるものとして普及しているのがニッケル水素電池です。負極の還元剤は水素ですが、まさか水素ボンベがつながっているわけではありません。水素を大量に吸収する性質のあるニッケル系やチタン系の水素吸蔵合金が使われます。これらの合金は水素を単に吸着しているのではなく、完全に金属結晶の構造の中に取り込んで金属水素化物を作りますから、多量の水素を蓄えられるのです。構造はニッケルカドミウム電池と同様に帯状の電極を巻いたものが多く、電圧も同じ1.2Vです。
この電池は同じ体積ならばニッケルカドミウム電池の2倍程度の容量がありますが、両極共に重い金属を使っていますから、かなり重量があります。私が以前に使っていたノートパソコンはニッケル水素電池仕様だったのですが、電池だけで全体の半分程度の重さを占めていたと思います。ただし、単三程度の大きさならば重さは大して気になりませんし、普通の乾電池の代わりに使えて有害物質も含まないということで、ニッケルカドミウム電池を急速に置き換えつつあります。
ニッケルカドミウム電池とニッケル水素電池の概要を図3に示しておきました。2つの電池は割とよく似た構成になっていることがわかると思います。
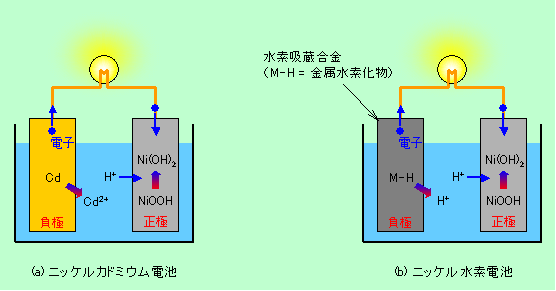
図3 ニッケルカドミウム電池とニッケル水素電池
(図は放電反応。充電では全ての矢印が逆)
ニッケルカドミウム電池もニッケル水素電池も、充電し過ぎて電極物質が足りなくなると水が電気分解して、正極で酸素が、負極では水素が発生することになります。これは非常に危険な状態なので、少々の過充電では問題が起きないような工夫がされています。それは、負極の物質(カドミウムまたは水素吸蔵合金中の水素)を多く詰め込むことです。こうすることで、少しぐらい過充電になっても負極に余裕がありますから水素の発生が起きないのです。正極では依然として酸素が発生しますが、この酸素はセパレーターを通過して負極に達すると水と反応して消費されますので、電池内にガスが溜まることはありません。
リチウムイオン電池
現在のところ二次電池の横綱格はリチウムイオン電池でしょう。俗に「リチウム電池」と呼ばれていますが、これでは充電できないリチウム電池と区別がつきませんから、正式に「リチウムイオン電池」と呼んだ方が間違いがありません。正極はリチウムを含んだコバルトやニッケル、マンガンなどの酸化物で、負極はカーボン(炭素)です。これらの粉末を、必要に応じて導電剤(カーボンブラックなど)と練り合わせて、正極はアルミ箔、負極は銅箔に塗布し、くるくる巻いて容器に密封するのが一般的です。
他の電池はほとんどが正極と負極で電子を出し入れする物質が違っているのですが、リチウムイオン電池の場合は両極ともリチウムが主役です。電池を組み立てた時点ではリチウムは正極に酸化物の一部として取り込まれていますが、充電すると、正極から電子が抜かれると同時にリチウムがイオンとして溶け出して負極へ移動します。負極では炭素の層状の構造の隙間にリチウムイオンが入り込み、外から来た電子を受け取ります(この時、リチウムイオンが電子を受け取って完全に金属に戻るのではなく、炭素とリチウムからなる構造全体で電子を保持します)。放電の時は逆にリチウムが負極から正極へと電解液の中を移動し、電子は外の回路を通って初めの状態に戻ります。このようにリチウムが正極と負極の間を行ったり来たりするだけの単純な動きで充放電しますので、「ロッキングチェア型」と呼ばれたりもします(図4)。
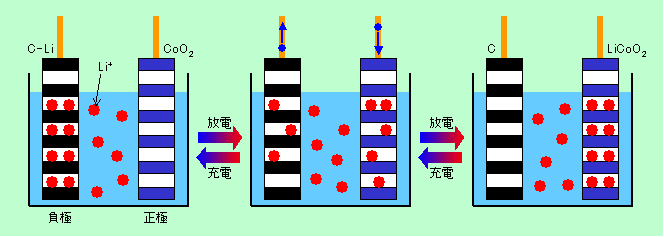
図4 リチウムイオン電池
電圧は正極の材料によって変わりますが、よく使われるコバルト酸化物や、ニッケル酸化物、マンガン酸化物では3.5〜4V程度の電圧が出ます。また、実際の電池には使われていませんが、バナジウム酸化物や鉄の酸化物のある種のものでは2Vぐらいの電圧になります。いずれにしても高電圧ですから当然水溶液の電解質は使えず、
電池の話(その1)に出て来たリチウム電池と同じ有機溶剤系の電解質を使わなければなりません。それも、4Vという高い電圧でも分解せず、しかもイオンを溶かし込める溶剤でなければなりませんから、種類は限られて来ます。
電池の内部に少しでも水が混じっていると、その水が電気分解して酸素と水素を発生します。できの悪い電池ですと使っているうちにだんだん膨らんで来て、最後には破裂、ということもあり得るのです。ですから電極材料や電解質は完全に脱水したものが必要ですし、組み立てには水を除去した環境を用意しなければなりません。またリチウムイオン電池に使われている有機溶剤は引火性のものが多いですから、他の電池もそうなのですが、特に液漏れには注意が必要です。もう一つ重要なのは、何かのきっかけで正極の酸化物が分解を始めると、その時に発生する熱でさらに分解反応が加速して暴走する危険があることです。こうなると有機溶剤に引火して爆発、という事態も起こり得るので、万が一に備えて、一個一個の電池に安全回路を備えたICが付けられていたり、何かの原因で温度が上がっても、セパレーターが溶けてイオンの通路を塞ぎ、反応を止めてしまう、というような工夫もされています。さらに「釘刺し試験」と言って、電池の横っ腹に釘を突き刺して正極と負極を短絡させ、安全性を調べる試験なども行なわれています。普段何気なく使っていると思いますが、安全性にはものすごく気を使って設計されている電池なのです。
最近は負極剤としてカーボン以外の物質も検討されています。その一つはリチウムと合金を作るシリコンやスズです。これらはカーボンよりも多くのリチウムを蓄えることができますが、リチウムが入った時と出た時とで体積が大きく変わるのが問題となっています。充電、放電のたびに電池が膨らんだり縮んだりすると液漏れなどの原因になりやすいですし、負極剤が集電体の金属から剥がれてしまうことにもつながります。これを防ぐために、カーボンなどの別の物質にシリコンやスズの粒子を埋め込んで体積変化を吸収する方法などが考えられています。
カーボンに代わるもう一つの候補は金属リチウムそのものです。余分なものが何もないのですから、どう考えてもこれに勝る容量の負極剤はありません。ではなぜこれまで使われなかったかというと、放電でリチウムが一旦溶けた後に充電で金属に戻すと、元のような平坦な状態ではなく、木の枝のような形に析出しやすい性質があるからです。この木の枝状のリチウムがセパレーターを突き破って、正極と短絡するなどの事故を起こすことがあるため、実用化は無理と言われていました。ところが最近になって、電解液を工夫することで木の枝状リチウムの成長を抑制したり、電解質を固体にするなどの方法が現実味を帯びて来ました。そのうちに負極に金属リチウムを使った電池が登場するかもしれません。
余談になりますが、炭素を使わないで、リチウムを出し入れする電位が違う酸化物どうしを組み合わせて電池を組むことも可能です。例えば通常のコバルト酸化物を正極にし、負極にはバナジウム酸化物などを持って来ると、1.5Vぐらいで動作する電池ができるのです。この電圧ならば水溶液系の電解質が使えますから、実用性はともかく、リチウムイオン電池の動作原理を見る実験には好都合ですし、電極物質の特性を水溶液を使って簡便に調べることもできます。
その他の二次電池
実際に広く使われている二次電池は上に挙げた4種類ですが、「小型で誰でも手軽に使える」という条件を外せば、その他にも様々な種類の電池があります。亜鉛-塩素電池や亜鉛-臭素電池と呼ばれるものは、負極が亜鉛で正極が塩素や臭素です。もちろん塩素や臭素は気体ですからそれ自体が電極にはなりません。水溶液に溶かした形で使い、炭素でできた電極上で反応させるようになっています。このタイプの電池では塩素や臭素を電極の傍にたくさん保持しておくことができませんから、電池とは別のタンクに大量に貯蔵しておき、使う時にポンプで炭素電極のところに送り込むのが普通です。「ポンプを動かすのに電気がいるではないか」と言われるかもしれません。実はその通りです。ですから、ポンプを動かしても余りあるだけの電気が蓄えられなければ意味がないわけで、大型のシステム専用、ということになります。
ナトリウム-硫黄電池(NAS電池)というのもあります。ナトリウムも硫黄も軽い元素ですから重さあたりの容量は非常に大きなものが作れ、電圧も2V程度とかなり高めなのですが、残念ながら300℃以上の高温でないと動作しません。金属ナトリウムの融点は98℃ですから、この温度ではナトリウムは溶融状態です。こんな状況では普通の溶液状の電解質は使えませんから、アルミの酸化物の一種であるβ-アルミナが固体電解質として使われています(
電池の話(その1)で普通の電池で実用になっている固体の電解質はないと書きましたが、このような高温では固体でも実用レベルの導電性が出る場合があります。このケースのβ-アルミナもナトリウムイオンをよく通します)。またβ-アルミナは電子は通しませんから、正極と負極を分離するセパレーターの働きも兼ねています。
ちょっと変わったところでは、レドックスフロー電池というのがあります。これは原理は単純で、価数が変化する(つまり酸化還元)時の電位が違う2種類の金属イオンを組み合わせただけです。鉄やクロム、バナジウムなどの金属イオンが水溶液状態で使われますが、溶液の形態ではそれほど濃度を上げられませんから、電極の傍に多量に保持することができません。そこで亜鉛-臭素電池などと同様に溶液は別のタンクに蓄えて、ポンプで電極のところを循環させる方式になります。
図5にこれらの電池の概略を示しました。
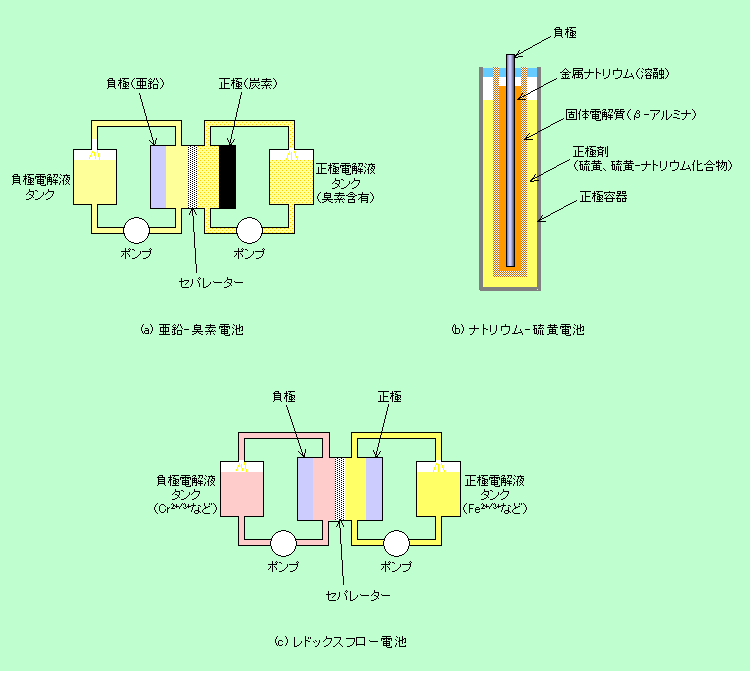
図5 大型の二次電池3種
これらの大型電池は1980年代〜90年代に国家プロジェクトとして開発が進められました。主に電力会社で、電力需要が少ない時間帯に多量の電力を蓄えておき、需要が多い時間帯に利用しようというものです。一応はパイロットプラントの稼動まで持って行ったようですが、その後はどうなったのでしょうか。
電池というより発電機 ― 燃料電池 ―
電極で反応する物質を電池内部に蓄えるのではなく、外から供給するのが燃料電池です。その意味では「電池」というよりも「発電装置」に近いものかもしれません。学校で図6のような装置で水の電気分解をしたことがありませんか。この時の電極は銅やステンレスだったと思います。電解液として水酸化ナトリウム水溶液などを使うと、正極には酸素の泡が、負極には水素の泡が付着します。ここで電池をはずして代わりに発光ダイオードをつないでみましょう。うまくいけば、ほんの一瞬ですが点灯します。これが燃料電池です。電極を金属から炭素棒に代えると、さらによく点くはずです。
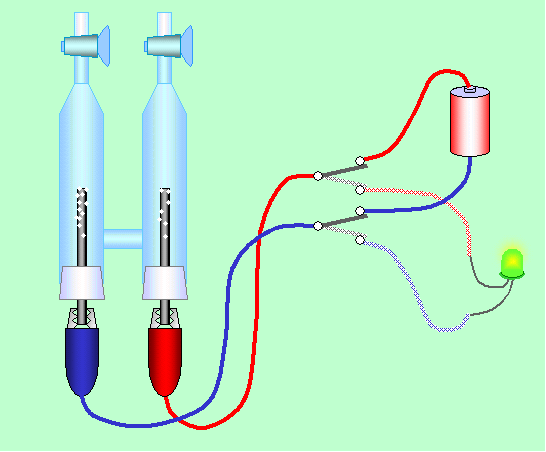
図6 簡単な燃料電池の実験
水素と酸素は別々のガスでいるよりも反応して水になった方が安定です(だからこそ水を分解するのに電気エネルギーが必要なのです)。しかし安定な方へ向かう途中に超えなければならないエネルギーの高い山があるので、水素と酸素を混ぜただけでは何も起こりません。ライターで火を付ける、などの刺激が必要です(
電気分解の話参照)。ところが水素や酸素が固体の表面にあると、その固体の触媒作用で山が低くなり、反応が進みやすくなります。先の実験で発光ダイオードが点灯したのもこのような理由によります。特に炭素棒などでは、孔がたくさん開いていて多量のガスを抱え込める上に触媒作用も大きいので、うまく燃料電池が機能したのです。
とはいうものの、図6の電池では発光ダイオードを光らせるのが関の山で、豆電球の点灯すら困難です。これでは使いものになりませんから、実際の燃料電池では、触媒作用の強い白金やパラジウムの微粒子を炭素の粒子や繊維に乗せたものが電極に使われています。また温度が高い方が反応には有利なので、高温で動作する燃料電池がいろいろと開発されています。この場合、電解質が普通の水溶液では沸騰してしまいますから、高温でも揮発しないリン酸が使われます(温度は200℃ぐらい)。電解質がリン酸の場合は二酸化炭素の影響を受けないので、正極用のガスとして空気をそのまま使うことができる、という利点もあります(電解質がアルカリですと空気中の二酸化炭素と反応して変質してしまいます)。さらに高温用のものでは、炭酸塩を加熱して溶かしたもの(600〜700℃)やセラミックスの電解質(1000℃以上)が使われる場合もあります。これらとは別に、高温型ではありませんが、フッ素系の高分子膜を電解質に用いた燃料電池も作られています。
図7は一般的な燃料電池の模式図です。負極では水素が解離してイオンとなり、電解質の中を移動して、正極で酸素(空気)と反応して水になります。高温型の電池では、発生した水は水蒸気として外に捨てられますので、電解質が薄まることはありません
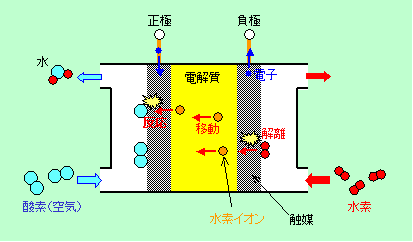
図7 燃料電池のしくみ
現在最も普及しているのはリン酸型の燃料電池です。電解液は、結構ドロドロ状態であるとは言っても一応は液体です。一方、燃料として供給される水素や酸素(厳密には酸素は燃料ではなく酸化剤)は気体ですが、これらの液体と気体が電極の触媒上でうまく接触しなければなりません。触媒部分では気体は楽に通過するけれども液体は漏れない、ということが要求されるのです。そこで触媒の部分は、電気をよく通すための炭素と、触媒として働く白金やパラジウムなどの金属、それに液体をはじくフッ素系樹脂を混ぜ合わせて作られています。
燃料電池では水素と酸素が反応した時のエネルギーが全て電気に変わるわけではありません。実は半分ぐらいは熱となってしまいます。この熱をそのまま捨てるのはもったいないですから、電池自身を暖めるのに使い、さらに余った熱は給湯用などに使い回すシステムが作られています。
燃料電池でもう一つ付け加えておかなければならないのは、水素の供給法です。酸素は空気を使えばよいのですが、水素は何とかしなければなりません。これには大きく分けて2通りの方法があります。一つは水素ボンベを使う方法、もう一つは別の有機物を分解して水素を取り出して使う方法です。電気自動車用や据え置き型の燃料電池では、これら2つの方法が主導権争いをしています。ボンベを使う方法は、余分な設備が要らないという利点がありますが、頑丈な水素ボンベが必要ですし、ボンベへの水素の詰め替えがやっかいです。一方有機物を分解する方法では、分解のための設備(改質器と呼ばれます)が必要ですが、ガソリンやアルコール、都市ガスなどの供給しやすい形の原料が使えます。その他、水素吸蔵合金などの水素を貯蔵する性質のある物質を利用する方法もありますが、これらは考え方としてはボンベ型に属するでしょう。
これらとは別に、燃料として水素ではなくメタノールをそのまま使うタイプの電池(ダイレクトメタノール型燃料電池)もあります。この電池では負極でメタノールが水と反応して水素イオンと二酸化炭素を作ります。できた水素イオンが正極に移動して酸素と反応する部分は、水素を燃料とした電池と変わりありません。メタノールを入れたカートリッジを交換する形で燃料を補給でき、携帯パソコンなどの電源として期待されています。ダイレクトメタノール型の問題点の一つは、メタノールが負極で反応しないで正極まで行ってしまう場合があることです。本来は負極で取り出されるはずの電子がメタノールにくっ付いたまま正極に届いてしまうわけですから、外に電流を取り出すことができません。そこでセパレーターの部分の通路を狭くして、水素イオンは通り抜けられますがメタノールは通れないようにするなどの工夫がされています。また、負極での反応の途中でできる一酸化炭素が触媒をダメにしてしまう、という問題もありますが、これについては、触媒の組成を改良するなどの対策が採られています。
スピードならNo.1 電気二重層キャパシタ
これまでの電池は全て何らかの化学反応を伴うものでした。正極や負極に仕込んだ物質全部が反応にかかわることができますから(実際に全部使うかどうかは別として)容量は大きいのですが、反応のスピードがそれほど速くはないので、一度に大きな電流を取り出すのには限界があります。これと対極にあるのが電気二重層キャパシタです。最後にこの電気二重層キャパシタを取り上げましょう。
電気回路に使うコンデンサはご存知ですね。2枚の極板を狭い間隔で向かい合わせたもので(間は空気ではなくて絶縁体を挟んだものが多いですが)、それぞれの極板に正負の電荷を溜めることができます。当然、極板の面積が大きいほど多くの電荷を蓄えられます。また極板の間隔を狭めると、蓄えた電荷の量が同じ場合は極板間の電圧が下がりますから、同じ電圧まで充電するとそれだけ多くの電荷が蓄えられることになります。そこで、極板の面積を思い切り大きくし、その間隔をできるだけ狭くしてやれば、電池の代わりになるくらいの電気が蓄えられる、というわけです。ところが普通に金属製の極板を使った場合、極板間隔を近付けるといっても限度があります。薄い絶縁膜を挟む場合でせいぜい数μm、アルミの表面を酸化して薄い酸化アルミの膜を作る場合でも数nmです。仮に極板間隔が1μmだとすると、単三のマンガン電池並みの容量を1.5V充電で得るには、数km四方の面積が必要なのです。この状況を一気に解決するのが電気二重層キャパシタです。
一組の電極を電解液に浸して電圧をかけると、例えば正極の表面には負イオンが寄って来て、図8のような層を作ります。これが電気二重層です。電解液側にできた負イオンの層は、ちょうどコンデンサーの負極板のような働きをし、ここに一種のコンデンサーができます。このコンデンサーの極板間隔は、イオンと電極との距離ですから1nmもありません。究極のコンデンサーというわけです。負極側にも同じようなコンデンサーができますので、全体として2つの究極コンデンサーが直列につながった構造になっています。これが電気二重層キャパシタです。コンデンサーは直列につなぐと容量が減ってしまうのですが、片一方だけを取り出すわけには行きませんから、これは仕方がないということで諦めましょう。なお、「コンデンサー」という言葉と「キャパシタ」という言葉ですが、どうもはっきりした区別はないようです。通常は、電気回路の部品として使う容量の小さいものを「コンデンサー」、電気エネルギーの貯蔵に使う容量の大きいものを「キャパシタ」と呼んでいるようです。
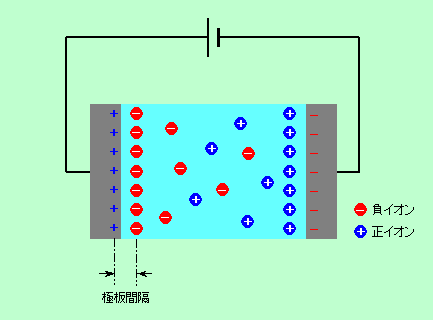
図8 電気二重層キャパシタは究極コンデンサーの2個セット
実際の電気二重層キャパシタでは、電極として1gあたりで1000m2以上の表面積を持つ活性炭を使いますから、一般のコンデンサーと比較すると容量は非常に大きくなります。通常の電気回路に使うコンデンサーの容量は普通は大きいもので数μF(マイクロファラド)で、特に大容量の電解コンデンサーでも数千μF、つまり0.01F(ファラド)以下です。これに対して電気二重層キャパシタは、コインサイズでも数F。まさに桁違いです。
キャパシタの電圧は電池と違って充電を進めればいくらでも高くなるのですが、電圧を上げ過ぎると電解液が分解してしまいますから、硫酸などの水溶液系の電解質を使ったキャパシタでは1.5Vぐらい、リチウム電池と同じような有機溶媒を使ったキャパシタでは2V〜4Vで使われるのが普通です。参考までに、図9に、普通の電池とキャパシタの充放電の特徴を比較して示しました。電池では電極で化学反応が起こりますから電圧は一定で、反応物質が不足して来ると急に電圧が変化し始めます。これに対してキャパシタでは、電圧は最初から最後まで直線的に変化します。
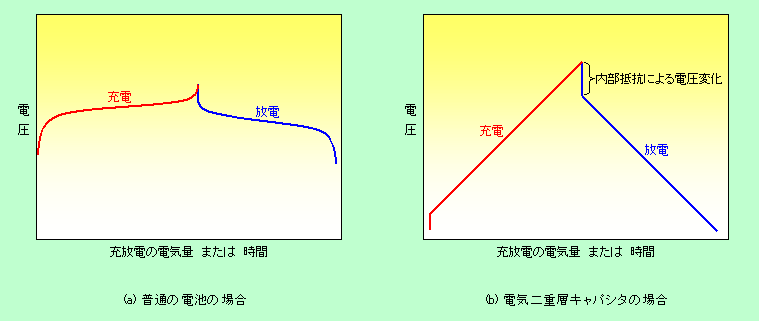
図9 電池とキャパシタの充放電特性の比較
キャパシタの特徴は何と言ってもその高速性です。化学反応が起こりませんから、それこそアッという間に放電させることができるのです(もちろん充電も速いです)。普通の電池では、蓄えている電気を全て吐き出すのに速くても数十分かかります。これよりも速く放電させようとすると反応が付いて行けず、いっぺんに電圧が下がって、ろくに電気も出せずに放電終了となってしまうのです。これに対してキャパシタでは数秒〜数十秒で、大したロスもなく放電できます。つまり単位時間に取り出せるエネルギー(出力)が大きいのです。また化学反応を伴わないということで、充放電を繰り返しても状態がほとんど変化しません。その結果、普通の二次電池では数百回しか繰り返し充電ができませんが、キャパシタでは10万回でも可能と言われています。
高速性や充放電回数では文句なしなのですが、容量という点ではやはり電池に分があります。イオンには一定の大きさがありますから、電極表面にびっしり並べた状態が限界で、1cm2あたり数μF。電池でよく使う単位に換算すると、1.5Vで充電するとして、1g程度の活性炭で数十mAhになります(電池の容量は蓄えられる総電気量で表しますが、コンデンサーの容量は1Vあたりの電気量で表されます。ですから電池と同じ単位で表現しようとすれば、電圧を決めてやる必要があるのです)。容器に目いっぱい活性炭を詰め込んでも、容量は電池の10分の1ぐらいでしょうか。ただしこれは、それぞれ理想的な条件で放電した時の話で、大電流で放電すれば電池の実質的な容量は激減しますから、これほどの差はなくなります。最近ではスピードを多少犠牲にして容量を多くしたものや、電気二重層と電池的な化学反応とを組み合わせた構成のものも出てきており、キャパシタの容量そのものもずいぶん大きくなって来ています。用途に応じて様々なタイプのキャパシタが使い分けられるようになって来ているわけです。
雑科学ホーム
hr-inoueホーム









