
雑科学ホーム
hr-inoueホーム
● 電池の話(その1) ●
電池2000年の歴史
バグダッドの2000年前の遺跡から古代の電池と思われる壷が発見された、という話を聞いたことがある人も多いでしょう。陶器製(つまり絶縁体)の壷の中に銅製の筒と鉄製の棒を入れた構造で、壷の中に酸を入れれば間違いなく電池になる構成です。誰がどのようにして作り出し、何に使っていたのか・・・・・。私は考古学者ではないのでよくわかりませんが、とにかく、こういうものが2000年前に実在していたことは事実です。ところがその後、大きな発展はほとんどなく、ようやく1800年になってボルタが有名な「ボルタの電池」を発明することになるのです。
その後の電池の発達は言うまでもないでしょう。身の回りは電池で溢れています。その種類も、ボルタの電池の延長線上にあるものから、充電可能な2次電池、高電圧仕様のリチウム電池、さらに最近注目の燃料電池から太陽電池に至るまで、実に多種多様です。最近では、もう行き着くところまで行ったと思われていた普通の乾電池でさえ、新しい方式のものが現れているのです。
この稿では電気化学の詳細にまで踏み込むつもりはありませんが、世の中に出回っている一次電池(充電できない使いきり電池)について、一通り見てみることにします(充電可能な二次電池やその他の電池については
電池の話(その2)に記載しています)。
電位が違うものを組み合わせれば電池になる
電池の基本構成は、正極と負極、そしてそれを電気的につなぐ電解質です。バグダッドの古代電池では正極は銅で負極は鉄、普通のボルタの電池では正極は同じく銅ですが、負極は亜鉛やスズを使います。とにかく、電子のエネルギーが違っている、つまり電位に差がある2種類の物質を組み合わせればよいわけです。(なお、この稿では電子のエネルギーを中心に話を進めますので、電位がマイナスに大きいほど「電位が高い」と表現することにします。)
それでは、電解質なしで亜鉛と銅を空中に置き、その間を豆電球でつないだら、電球は点くでしょうか。点くはずありませんね。なぜでしょう。確かに亜鉛と銅では電位が違いますから、電位が高い亜鉛の中の電子は豆電球を通って銅に移動します(実際には1個の電子が長い距離を動くわけではなくて、近くの電子をちょっとだけ押すことで玉突きのように動きが伝わって行くのですが)。しかし、ほんの少し電子が移動しただけで銅の電位は上がり、亜鉛の電位は下がってしまいますから、両者の電位差はすぐになくなって、電子の動きが止まってしまうのです。では、電子の動きを止めないためにはどうすればよいでしょうか。亜鉛にできた電子の孔を埋め、銅に溜まった余分な電子を取り去ってやればよいのです。この働きをするのが電解質です。
具体的に見てみましょう。図1にボルタの電池の構成を示しました。負極では亜鉛から電子が出て行き、あとに孔があきますが、電極材料の亜鉛そのものが陽イオンとして溶け出すことで、孔を取り去ってしまいます。一方正極では、銅に移った余分な電子が液の中の水素イオンと結びつき水素ガスとなって出て行きますから、余った電子はなくなります。
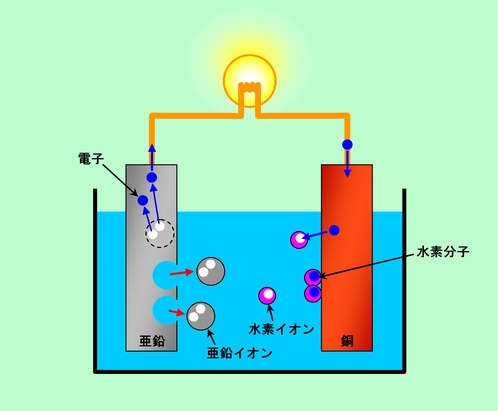
図1 基本の基本、ボルタの電池
ボルタの電池では、正極で発生した水素が電極表面を覆って電子の移動を邪魔したり逆方向の反応を起こしたりして、すぐに機能を停止してしまいます。これを防ぐために液中に銅イオンを加えて、正極での電子の受け取りをこの銅イオンに任せ、水素の発生をなくす、という方法が採られます。この場合、銅イオンが負極側にもあると、負極の亜鉛の上にも銅が析出してしまいますから、そうならないように正極側の電解液と負極側の電解液を分離します。ただし分離するといっても、完全に分けてしまったのでは(電解質がない場合と同じように)正極側に電子が溜まり両方の極の電位差がすぐになくなって電流が流れなくなります。そこでイオンが移動して電荷の偏りをキャンセルできるように、細かな孔があいた多孔質膜やイオンを溶かし込んだゲル(寒天)が隔壁として使われます。これがダニエル電池です(図2)。
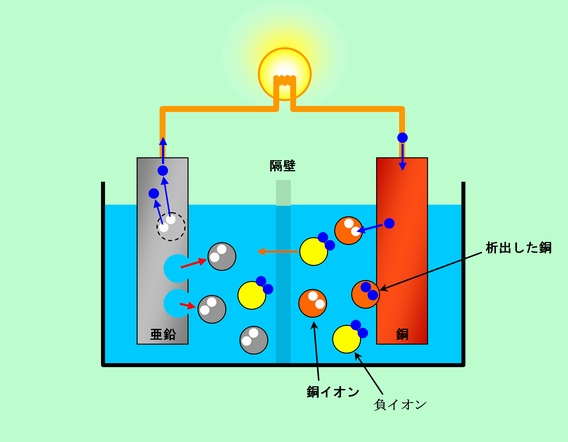
図2 ダニエル電池はボルタの電池の改良型
世に出回っている様々な電池も、基本構成はボルタの電池やダニエル電池と変わりありません。負極は電子を外に出す反応が起こりやすい系、正極は外から電子を受け取りやすい系になっており、電解質は負極や正極に溜まった電荷を取り除く働きをするわけです。そしてこの反応が一方向にしか進まず、一回使ったら終わりになるのが一次電池、逆方向に電源をつなぐと全く逆の反応が起こって元の状態に戻るのが充電可能な二次電池、ということになります。
ところで、負極での反応は電子を外に放り出す方向ですから酸化反応です。一方正極では電子が外から入ってきますから還元反応が起こっています。つまり、負極材料は酸化反応を起こす材料(自身が酸化されるわけですから他の物質を還元する、即ち還元剤)であり、正極材料は還元反応を起こす材料(自身が還元されるわけですから他の物質を酸化する、即ち酸化剤)であることになります。ですから電池というのは、「還元剤の負極と酸化剤の正極とを電解質でつないだもの」、ということもできます。ついでに触れておくと、負極では酸化反応が起きますからこれはアノード、正極は還元反応が起きますからカソードです。電気分解の場合とは関係が逆なのです(
電気分解の話参照)。
電池の性能
電池の性能を表すポイントは、使い勝手などを別にして、大きく分けて3つあります。それは「電圧」と「容量」と「エネルギー」です。それでは一つずつ見て行きましょう。
電 圧
電圧は基本的には正極と負極の電位差ですから、電池の構成が決まれば決まってしまうはずです。ところが現実的にはそうは行きません。電池自身が電気抵抗を持っているからです。この抵抗のことを内部抵抗と呼びますが、自分自身が持っている内部抵抗によって、起電力の一部を消費してしまうのです(厳密に言えば放電に伴う電解液の組成変化によって電極の電位も変わるのですが、これはとりあえず無視します)。
図3を見てください。図3(a)のような内部抵抗のない理想的な電池の場合、外部にどんな抵抗をつなごうが電圧はいつでも一定で起電力そのものになります。ところが内部抵抗がある場合、電池の起電力は内部抵抗と外部の抵抗の2つに分配されますので、肝心の外部に取り出せる電圧は少し減ってしまうのです(図3(b))。この影響は、外部につないだ抵抗が小さいほど、つまり流れる電流が多いほど大きくなりますから、内部抵抗の大きい電池は大電流には向かない、ということになります。
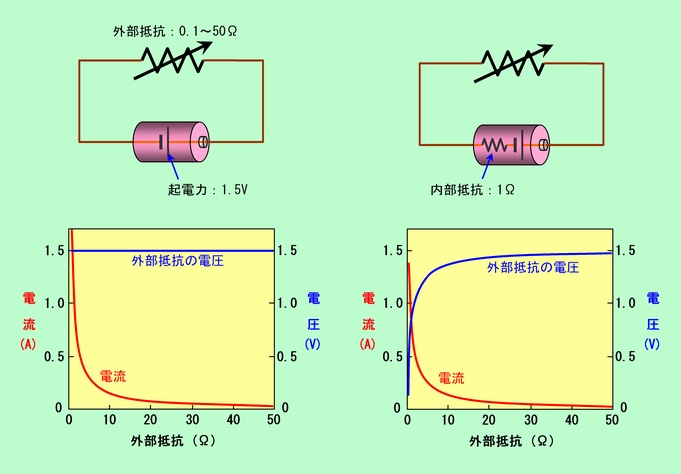
図3 内部抵抗は実質的な電圧を下げる
内部抵抗の起源はいろいろありますが、主なものは電解液の抵抗と電極反応の抵抗です。電解液で電荷を運ぶのはイオンですから、さすがに導線の中の電子のようには行かず、そこそこの抵抗が出ます。また正極や負極で起こる反応も、何の障壁もなくサッサと進めばよいのですが、実際には反応を邪魔する様々な要素があって抵抗の源になります。
電池を使っていて十分な電流がとれなくなると、「電池がなくなった」と言いますね。これは必ずしも、電極の材料が全部反応してしまった、というわけではありません。使っているうちに電解液の組成変化や電極表面の状態変化で内部抵抗が増加し、十分に電圧を取り出せなくなったことが原因なのです。ですから大きな電流が必要なモーターや電球には使えなくても、小さな電流で済むリモコンや時計には十分に使える場合もあるのです。この場合、リモコンや時計が電圧不足でも動くというわけではなく、図3(b)のように、電流が小さい時にはちゃんと電圧が出ているから動くのです。
電池の残量があるかどうかを調べるのに乾電池チェッカーなるものをよく使います。安価なものは別にして、これは単なる電圧計ではありません。普通の電圧計は抵抗がものすごく大きいので、無視できるほどの微弱な電流しか流れませんから、古くなって内部抵抗が大きくなった電池でもまともな電圧が出てしまうことがあるのです。これに対して乾電池チェッカーでは、適当な大きさの抵抗を通して電流を流し、その時の電圧をモニターするようになっていますから、実際に使えるかどうかの判定ができます。電気回路を調べるテスターに、通常の電圧測定モードとは別に電池の電圧チェックのモードが備わっている場合がありますが、これも同じ理由です。
内部抵抗に絡んで話題を一つ。それは、電池を2個つないだ時の話です。小学校の理科では、電池を2個直列につなぐと1個の時と比べて2倍の電圧がかかるので電流も2倍になり、つないだ豆電球は明るく光るが、電池を2個並列につないだ時は豆電球の明るさは変わらない、と習いました。しかしこれは内部抵抗が全くない時の話です。電池を直列につなぐと確かに起電力は2倍になりますが、新しく追加した電池の内部抵抗の分だけ全体の抵抗も増えるので、電流は2倍にはなりません。2倍よりもちょっとだけ小さくなってしまうのです。一方並列の場合には、起電力は1個の時と同じですが、電流が2つの電池に分かれて流れますから、内部抵抗の影響は半分になります。そのため外部回路を流れる電流は少し増えますので、つないだ豆電球は電池1個の時よりもほんのちょっとだけ明るくなるのです。学校で習うのは理想の世界。現実はもう少し複雑なのです。
ついでにもう一つ。理科実験では普通にやっている電池の並列接続ですが、実際の機器ではしないほうが無難です。複数の電池の状態が全く同じということはほとんどありませんから、電流は内部抵抗の小さい電池を優先的に流れ、事故の原因になりやすいのです。また古くなって電圧が下がった電池が混ざっている場合も問題です。直列の場合でも、残量の少ない電池が混ざっていると、その電池に無理やり電流が流されて過放電状態となり危険ですが、並列では電池の同じ極どうしがつながっていますから、弱い電池に逆方向の電流が流れるおそれがあり、余計に危ないのです。特にスイッチを切っている状態ですと、まさに強い電池で弱い電池を充電する形になりますから非常に危険です。十分に注意しましょう。
容 量
容量というのは、どれくらいの電気を蓄えているか、という指標です。電池の外装に600mAhとか1200mAhとかの表示がある場合がありますが、これが容量の値です。言うまでもなく600mAhというのは600mAの電流を1時間流せる容量、ということを意味しています。
容量を決めるのは電極材料の種類と量です。例えば亜鉛の場合、1gの亜鉛には9×1021個の原子が含まれ、1個の原子が2個の電子を出しますから、1gの亜鉛が出すことのできる電子の数は18×1021個です。1mAhの電気量は電子2.25×1019個に相当するので、亜鉛1gの容量は約800mAhとなります。細かい数字はともかく、少ない重さ、少ない体積でたくさんの電子を出し入れできる物質が電極材料として適していることはおわかりでしょう。普通の乾電池では大きさが制限されていますから、単位体積でどれだけの容量が出せるかが重要になります。また電気自動車に載せる電池の場合、体積が小さい方が有利なのは当然ですが、車体の重さを減らす意味で重量当たりの容量も重要になります。
金属としてはできるだけ軽くて価数の大きいもの、例えばアルミニウムなどが、重さ当たりの容量を稼ぐには最適、ということになります。ところがアルミニウムは表面にできる酸化膜で保護される性質があるので、電解液中になかなか溶け出しません。反応の抵抗がものすごく大きいのです。というわけで、現実の電池では負極用の金属として亜鉛やリチウムが使われています。一方の正極材料としては、酸化剤ということで酸素を含んだ化合物(酸化物)が使われる場合が多くなります。その代表が二酸化マンガンです。
ところで、容量と言っても、それは電極物質が全部反応してしまうまでの値ではありません。電池としての性能を出すには或る一定以上の電圧が必要ですから、実際には必要最小限の電圧が出せなくなるまでの電気量がその電池の容量ということになります。こうなると、先の内部抵抗の影響が出て来ます。内部抵抗が大きな電池では実質的な電圧が小さくなりますから、それだけ早く限界値に達してしまうのです。また同じ内部抵抗の電池でも、図3(b)のように大きな電流を流して放電すると電圧のロスも大きくなりますから、容量は小さく見えてしまいます。この様子を図4に示しました。
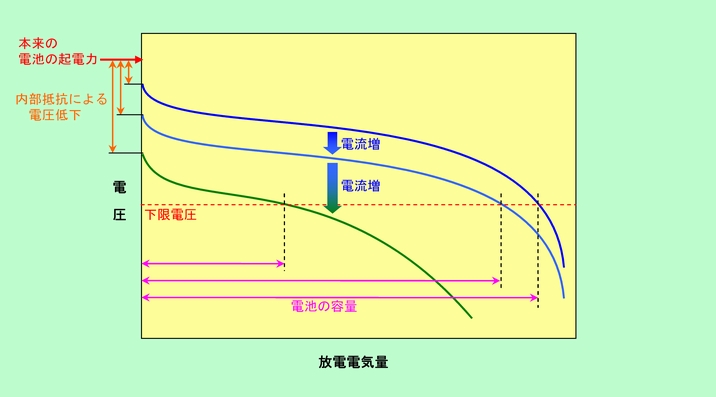
図4 電池の放電による電圧の変化
このようなグラフを描くには、常に一定の電流が流れるようにして放電しながら電圧を測定して行きます。初めは高い電圧を示しますが、電池内部の状態の変化で徐々に電圧が下がって行き、限界値(赤破線)に達するまでの電気量が容量となります。通常は公称電圧の80%とか60%を限界値とする場合が多いようで、例えば公称1.5Vの電池ならば1.2V、あるいは0.9Vになるまでの電気量ということです。
ここで放電時の電流を大きくすると、電池の起電力の一部が内部抵抗で消費されて電圧が下がります。内部抵抗が一定ならば電圧の低下幅も一定になりますから、放電電圧のグラフは単に下に平行移動するだけです。ところが電流を増したことで内部抵抗の増加も急激になる場合には、後になるほど電圧が大きく下がるようになります。さらに電流が増えて電極の反応が付いて行けなくなると、無理に流した電荷が電解質で処理しきれずに電極に溜まりますから、電圧がどんどん下がって、容量はいっそう低下してしまうのです。そこで、厳密に放電容量を言う時にはどのくらいの電流で放電したかを示さなければなりませんが、一般的には完全放電までに5時間かかるような電流で放電した時の容量を標準とするようです。
一つ付け加えておくと、電池の種類によっては連続で放電するよりも休み休み放電させた方が容量が大きくなる(つまり電圧の低下が遅くなる)場合があります。休んでいるうちに電池内部で起こった変化が部分的に回復するからです。そのため、休み休みの放電試験で容量を測定する場合もあるのです。このように容量の値というのは条件の設定の仕方でかなり変化しますので、容量を表示していない電池も多いのです。
エネルギー
単位時間あたりのエネルギーを電力と言い、電圧と電流の掛け算で表されることはご存知ですね。内部抵抗のある実際の電池から取り出される電力が条件によってどう変わるかを、図3(b)のケースで調べてみましょう。図5は、図3(b)に示した回路で外部抵抗で発生する電力を示したものです(電圧と電流も一緒に描いてあります)。この図からわかるように、電力は外部抵抗が内部抵抗と同じ大きさ(この例では1Ω)になった時に最大になります。外部抵抗が大きいと電流が小さくなり、逆に外部抵抗が小さいと内部抵抗で消費される電圧の方が大きくなって外に取り出せる電圧が小さくなるのですから、このような結果になるのは当然です。
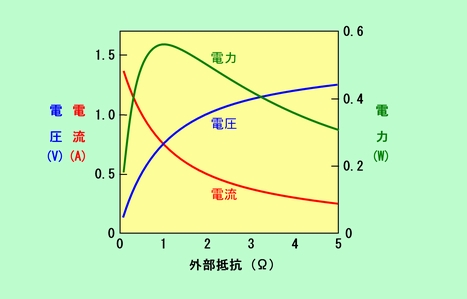
図5 電池の電力が最大になるのは?
それでは電池を使う時には、電池の内部抵抗と同じ大きさの抵抗を持った機器をつなぐのがよいのでしょうか。そんなことはありません。普通の電気製品は電池から最大の電力を取り出すことを目的としているわけではなく、自分に合った電圧と電流が得られればよいのですから。というわけで、図5のような最大電力が得られる条件、というのは、普通はあまり意味がありません。実際に1Ωというような小さな抵抗のものをつないだら大きな電流が流れ過ぎて、図4に示したようにアッという間に電圧が落ち込んでしまいます。
ところが、長時間持たなくてもよいから一時的に大きなパワーが要求される場合があります。例えば電気自動車の起動がそうです。またここまでは行かなくても、模型のモーターなどを起動する時には安定に回っている時よりも大きな電力が必要です。このようなケースでは、「電圧を落とさずにどれだけ大電流を流せるか」、ということが重要で、保持時間はともかく、どれだけの電力が供給できるかという能力が電池に求められるのです。そこで、単位量(重量、体積)あたりの供給可能電力、というのが電池の性能の一つとされるわけです。この性能を上げるためには、内部抵抗が小さく、電極反応が速いことが要求されます。
電池いろいろ
普通の乾電池
ここからは実際に使われている電池を少し見てみましょう。図1のような液体チャプチャプの構造では扱いにくいですから、液を繊維に染み込ませたりゲルにしたりして固定し、缶に密閉したものが開発されました。「乾電池」です(本当に乾いているわけではありません。本当に全ての要素が固体になった電池というのは、研究は盛んですが、まだ実用にはなっていません)。
乾電池の中で最も歴史が古く、今でも広く使われているのがマンガン電池です。これに対して、容量を大きく、しかも大電流が流せるように改良されたのがアルカリ電池(アルカリマンガン電池)です。それぞれの電池の構造を図6に示しました。
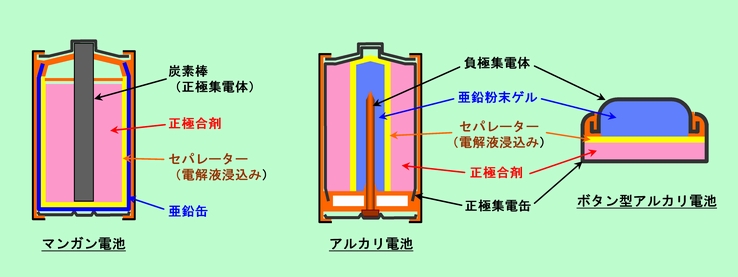
図6 マンガン電池とアルカリ電池
どちらの電池も電極材料は同じで、負極は亜鉛、正極は二酸化マンガンですが、その詰め方が違います。マンガン電池では、亜鉛の缶の中に正極合剤(二酸化マンガンを炭素の粉と練り合わせたもの)と電解液とを詰め込み、電気を取り出すための炭素棒を真中に突っ込んだ形です。電解液は塩化アンモニウムや塩化亜鉛の水溶液で、弱酸性の液です。一方アルカリ電池の方は、外側が正極合剤で、内側が樹脂を使ってゲル状にした粉末亜鉛です。こうすると亜鉛をたくさん詰め込むことができ、また粉末状にすることで速い反応にもついて行ける、つまり大電流を取り出せるのです。最も大きな違いは電解質で、アルカリ電池では文字通りアルカリ性の水酸化カリウムや水酸化ナトリウムの水溶液が使われています。この方がマンガン電池の酸性液よりも抵抗が小さく、大電流に有利なのです。
正極材と負極材の間にはセパレーターと呼ばれる多孔質の膜があります。ここには電解液が浸み込んでおり、正極と負極が短絡するのを防いでいます。イオンはセパレーターを通して行き来できますが、電子はセパレーターを通過することはできません。
マンガン電池は真中の炭素棒が突き出た部分が正極になりますから、あの形は意味があります。ところがアルカリ電池の方は、内部構造からして、マンガン電池と同じ形にする必要は全くありません。しかし使われ方が同じですから、古くからのマンガン電池と同じ形、同じ大きさにしておかなければ都合が悪い、ということで、無理やりに形を合わせてあるのです。
アルカリ電池の最大の特徴は大電流に強いということですから、大電流が必要な用途、例えばモーターや電熱線、ランプなどに適しています。このような用途に使うと、大きな電流を流しながら高い電圧を維持でき、マンガン電池よりも寿命もずっと長くなるのです。逆に電流をあまり必要としない時計やテレビのリモコンなどではアルカリ電池とマンガン電池の差はほんの少し。値段はアルカリ電池の方がかなり高いですから、これでは割が合いません。もっとも最近では100円ショップにアルカリ電池が並ぶこともあり、以前ほど割高には感じなくなっていますけど・・・・・。
なお、アルカリ電池には円筒型ではなくボタン型のものも多く出ています。LRという記号がついている直径1cm余りの電池がそうで、図6にはこれの構造も示しておきました。
リチウム電池
負極として亜鉛の代わりにリチウムを使うとリチウム電池になります。カメラ用の少しずんぐりした円筒型のものや、直径2cm余りの薄いコイン型電池が出回っています。円筒型のものは、帯状のリチウム箔と正極合剤を塗布したアルミ箔をセパレーターを挟んで交互に重ね、くるくる巻いて詰め込んだ構造のものがよく使われます。こうすることで電極の面積が稼げますから、内部抵抗を下げるのに有利になるのです。一方コイン型の電池はボタン型のアルカリ電池とほとんど同じ構造です(図7)。
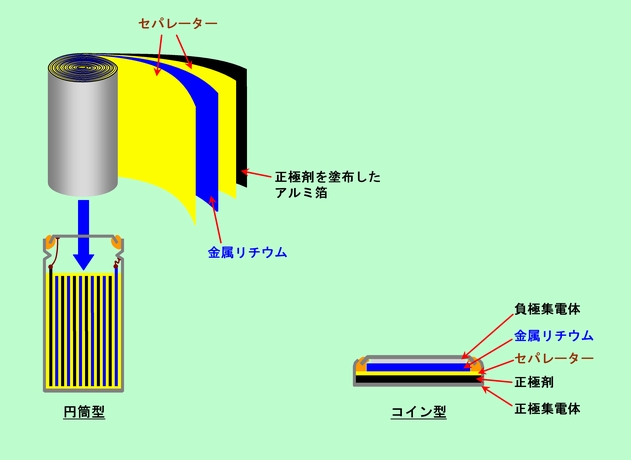
図7 代表的なリチウム電池
リチウムは軽い金属で、1gあたりの容量で比較すると亜鉛の5倍近い値になりますから、重さあたりの容量はズバ抜けています。そして何よりも特徴的なのは、その電圧の高さです。リチウムは亜鉛よりも2.3Vも高い電位を持っていますから、同じ二酸化マンガンとの組み合わせで3V以上の電圧が出せるのです(マンガン電池やアルカリ電池はご存知のとおり1.5Vです)。また、正極に二酸化マンガンではなくてフッ化黒鉛を使った電池もあります。こちらも電圧は3V以上です。
しかし、いいことばかりではありません。これだけ高い電圧になると水が電気分解してしまいますから電解液として水溶液が使えず、有機溶剤を使わなければならないのです。しかもその有機溶剤は完全に水を取り除いたものでなければなりません。わずかでも水が混ざっていると電池の中で電気分解して酸素と水素を発生し、電池がパンパンに膨れ上がって破裂、という事態を招くのです。溶剤のビンの蓋を開けて部屋の中にしばらく放置しただけでアウトです。そのためリチウム電池の組み立ては、完全に水を排除した密閉室の中で行なわなければならず、どうしても電池が高価になってしまいます。また、リチウム電池に使われている溶剤には引火性のものが多いですから、取扱いにも注意が必要です。子供のころに乾電池を分解して炭素棒を取り出したりした経験がある人も多いと思いますが(私もその一人です)、ことリチウム電池に関してはやめておいた方が無難です。電極から火花が飛んで爆発、ということになりかねませんから。
酸化銀電池
電卓などの小型機器によく使われているボタン型の電池です。負極はマンガン電池と同じ亜鉛ですが正極が酸化銀で、電解液はアルカリ水溶液。電圧は公称1.55Vですが、実際には初期には1.8V以上の電圧が出る場合もあります。この電池の最大の特徴は、とにかく安定していることで、少々温度が変わっても、数年間放置しても、ほとんど特性が変わりません。この特徴を活かして、時計や電卓などに広く利用されています。大電流を取り出せないのが難点ですが、時計や電卓は必要な電流が少ないですから問題ないのです。
亜鉛空気電池
負極は亜鉛ですが、正極の酸化剤として空気中の酸素を使う電池です。といっても、酸素を電解液に触れさせただけでは反応してくれませんから、図8のように、反応を助ける触媒を正極側に仕込んであります。電池の中に正極剤が不要ですから、その分負極剤をたくさん詰め込むことができ、同じ大きさの酸化銀電池の倍程度長持ちします。補聴器用の電源として普及しており、コンビニでも売られていますから、目にしたことがあるかもしれません。使う前に勝手に反応が進んでしまわないように正極の外側にシールが貼ってあり、これを剥がして使うようになっています。
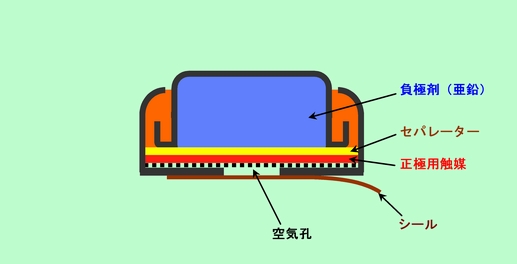
図8 亜鉛空気電池
ところで、単三型、単四型などのマンガン電池やアルカリ電池の場合は外装に印刷してありますから誰でもすぐにわかりますが、ボタン型やコイン型のものは、それがどのタイプの電池なのか、なかなか判断しにくいものです。そこで、記号による見分け方を下に示しておきましょう。
| 電池の記号 |
電池の種類 |
| 無記号 |
マンガン電池 |
| L |
アルカリ電池 |
| S |
酸化銀電池 |
| M, N |
水銀電池 |
| C |
リチウム電池(正極:二酸化マンガン) |
| P |
亜鉛空気電池 |
なお、これらの記号の後ろには電池の形を表す表示が続きます。丸型電池の場合は「R」が付いて、LRとかCRというふうに書かれます(角型電池などは「F」が付きます)。さらに数字が続きますが、これには2通りあります。一つは「LR44」というように1桁または2桁の数字で表されるもので、これは単なる登録番号です。番号が決まれば電池のサイズが決まるのですが、数字そのものには意味はありません。もう一つは「CR2022」というように4桁の数字で表されるものです。これはコイン型電池に多くみられ、初めの2桁がmm単位の直径を、後の2桁が0.1mm単位の厚さを示します。ですから、「CR2032」という電池の場合、「直径20mm、厚さ3.2mmのリチウム電池」、ということになります。今度ボタン型電池やコイン型電池を見る機会がありましたら注意してみてください。
一次電池の充電
最近、本来充電できないはずのマンガン電池やアルカリ電池を充電する器具を見かけることがあります。こんなことができるのでしょうか。結論から言えば、一応は可能です。しかしそれは本当の意味の充電ではありません。
マンガン電池の場合、負極の放電反応は亜鉛の溶解です。ここに逆の電流を流して充電すると、亜鉛が金属に戻る反応よりも水溶液中の水素イオンが水素ガスになる反応が優先しますから負極には水素が溜まります。一方正極では、放電反応は二酸化マンガンの還元ですが、充電すると水溶液中の塩素イオンが酸化されて塩素ガスを発生します。つまり、充電によって元の状態に戻るのではなく、全く別の生成物を作るのです。この電池をもう一度使うと、水素と塩素が電極物質として反応します。しかもその時の電位差は1.4V。そのため、まるで電池が復活したかのように見えるわけです。アルカリ電池の場合は電解液中に塩素が含まれていませんから正極で発生するのは酸素で、今度は水素と酸素が反応する電池ができるのです(これはまさに燃料電池です。詳しくは
電池の話(その2)
)。実際には本来の電極物質が部分的に元に戻ったり、電極近くに溜まった不要物が取り除かれる、ということもあるのでしょうが、やはりガスが電池内に溜まることは避けられません。内圧が上がって破裂するおそれもあるため、電池メーカーは充電しないように呼びかけています。どうしても充電して使いたい場合は自己責任で、ということですね。
雑科学ホーム
hr-inoueホーム








