
雑科学ホーム
hr-inoueホーム
● 超臨界流体の話 ●
物質には本当に三態があるか
物質には「固体」、「液体」、「気体」の3つの状態、即ち「三態」がある、と学校で習いました。では「固体」とは何でしょうか。物質を構成する分子が強く結合し、互いの位置を変えないで一定の形を保つ状態です。「液体」とは何でしょうか。分子は互いに位置を変えて運動できるが、ある程度の相互作用があり、一定の形は持たないがほぼ一定の体積を持つ状態です。それでは「気体」とは何でしょう。分子がほとんど相互作用をせずに自由に飛び回っており、形も体積も一定値を持たない状態です。
ここで、これらの定義をもう一度よく見てみましょう。分子が互いの位置を変えられるか変えられないか、という基準は、かなりはっきりしています。ですから固体と他の2つとは明確に区別できそうです(
粘弾性の話でも触れているように、ものすごく長い時間スケールで考えると、この差が曖昧になる場合もありますが)。それでは液体と気体の違いはどうでしょう。分子どうしの相互作用が強いか弱いか、体積がほぼ一定かどうか、という判断基準が示されていますが、どうも境目が曖昧です。現実的には、液体と気体の密度は3桁も違いますし、その中で手を動かした時の抵抗感も全く違いますから、この2つの状態を区別するのに何の問題もありません。あまりにも性質がかけ離れているので、通常は線引きする必要などないのです。しかし通常でない状態、例えば非常に圧力の高い気体がある場合、それが液体か気体かはどうやったら区別できるでしょうか。密度がいくら以上ならば液体、という基準はありませんし・・・・・。一つの方法は、その物質を加熱したり冷却したりしてみることです。そこで沸騰が起こったり凝縮が起こったりすれば、初めの状態が液体であったとか気体であったとかがわかります。ところが、ある特殊な状態では、そのような変化すら起こらなくなってしまうのです。これが「超臨界流体」と呼ばれる状態で、もはや気体と液体の区別はありません。「物質には三態がある」というのは、実は限られた条件範囲でのことであったわけです。
超臨界流体はどんな風に見える?
超臨界流体を実際に目にしたことがある人は少ないのではないでしょうか。普通の理科の実験室で手軽に作る、というわけには行きませんから。そこで、頭の中でこんな例を考えましょう。一度真空にした容器に水を半分ほど入れて密閉します。下半分は液体の水で、上半分は水蒸気です(真空にしたので空気は入っていません)。これを加熱したらどうなるでしょうか。図1にその時の状態を示しました。横軸が温度で、縦軸が密度です。
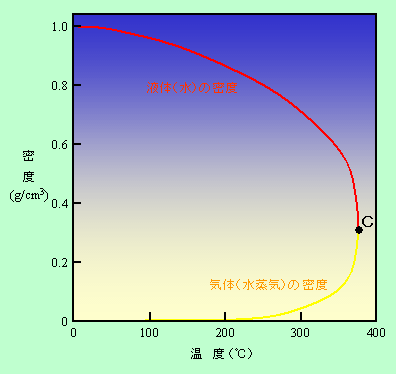
図1 密閉された水と水蒸気を加熱する
水は温度が上がると膨張しますから、水の密度は図の赤線のように徐々に下がって行きます。一方水蒸気の方は、水が次々に蒸発して来ますので、逆に密度が上がり(黄線)、両者はしだいに近付いてきます。初めは3桁も違っていた密度が、温度が300℃を大きく超えて来るとわずか数倍の差になるのです。この実験の場合は水という同じ物質の2つの状態が上下に分かれて存在していますから、かろうじて下側が液体で上側が気体であることがわかるのですが、一方だけを見せられると、これが液体なのか気体なのかわからなくなってしまいます。
さらに加熱を続けると両者の密度はどんどん接近して、ついには同じになってしまいます(図のC点=臨界点)。その瞬間に境界面も消滅し、全体が一様な、気体とも液体ともつかない流体、超臨界流体となるのです。
密度は圧力によっても変化することはご存知ですね。図1の実験では圧力の要素は示されていませんが、実は圧力は自動的に決まってしまうのです。その理由はこうです。液体が蒸発する時、その蒸気の最大圧力(飽和蒸気圧)は温度によって決まっています。容器の中には常に液体と気体の両方がありますから、もし圧力が飽和蒸気圧に達していなければ、水が蒸発して気体の圧力を高めることになります。また逆に圧力が飽和蒸気圧よりも高かったら、気体は凝集して水に戻り、圧力が下がるので、結局は飽和蒸気圧に落ち着くのです。しかし、初めに容器に入れた水の量が少なくて全部が蒸発してしまったら、もう蒸気の供給源がありませんから、飽和蒸気圧に達する前に圧力上昇が止まってしまい、図1のような変化を見ることはできなくなります。
実際に色々な物質でこの実験をやってみますと、はっきりしていた境界面が突然パッと消えてなくなる、というわけではなく、だいたい図2のような変化が見られます(この例は二酸化炭素で実際に観察した時の様子を模式的に示したものです。容器の覗き窓は丸いことが多いので、その雰囲気を出してみました)。

図2 超臨界状態になる瞬間はこんな感じ
初めは当然、はっきりした液面が観測できますが(図2(a))、気体と液体の状態が似通ってくると、両方がやや濁ると同時に夕焼け空のように赤っぽく色付いてきます(図2(b)〜(c))。これは液体全体あるいは気体全体が完全に一様ではなく、局部的に密度が高いところや低めのところが入り混じり、光を散乱することによります(夕焼けが赤いのと同じ理屈で、青い光は散乱されやすいのに対して赤い光は散乱されにくく、赤系の光だけが目に届くのです)。濁りや着色は境界面付近で特に目立ち、液面から陽炎が立ち昇るような状態も観測できます(図2(c)〜(d))。やがて境界面付近は真っ黒に近くなり、幅も広がってきて(図2(d))、ついには全体が黒くモヤがかかったような状態となります(図2(e))(これを臨界蛋白光と言います。反対側から強い照明で照らすとオパールのような散乱光が見えるからだそうですが、私の経験では、かなり強い照明を使っても真っ黒でした)。そして次の瞬間、雲が晴れるように再び透明になり(光散乱による着色は残っていますが)、その時には境界面もなくなっているのです(図2(f))。
超臨界の状態とは
先ほどは温度と密度の関係を示しましたが(図1)、超臨界流体の説明をするのには密度(または体積)と圧力、または温度と圧力の関係で示すのが普通です。この辺の話は色々なところに出ていますが、さすがに避けて通るわけにも行かないので、一応説明しておきましょう。
図3は二酸化炭素の体積と圧力の関係を示したものです。図には温度が違う6本のグラフが描かれています。まず一番下の0℃のグラフ(a)を見てください。右の方は圧力が低い領域で気体状態ですから、右端から左に向かって体積を小さくして行くと圧力は反比例で増加します(ボイルの法則)。そして、図のA点で液化が始まると、体積は一気に小さくなって、B点まで飛びます。A点とB点の中間の状態というのは存在しません。液化が進行している過程では、A点の気体とB点の液体とがいっしょに存在しているのです(この時の圧力が飽和蒸気圧です)。全てが液化してしまうと、今度は液体ですから、体積をちょっと縮めるにも大きな圧力が必要になり、グラフは急激に立ち上がることになります。
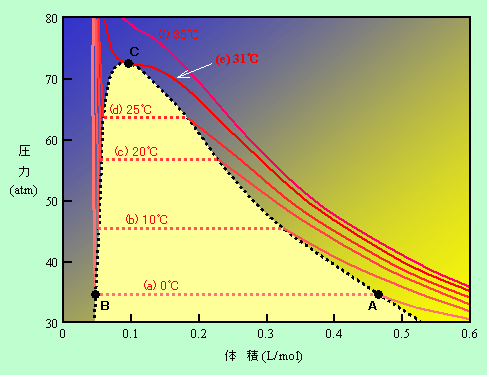
図3 体積と圧力の関係(二酸化炭素の場合)
温度を高くすると、グラフは(a)→(b)→(c)→(d)と移って行きます。A点とB点を結ぶ直線部分が短くなっていることに注意してください。そしてさらに温度を上げて31℃に達すると、この直線部分が完全になくなってしまいます(e)。これは、気体から液体に変わる(またはその逆の)プロセスがなくなってしまったことを意味しており、液体も気体もない超臨界流体になった、ということなのです。このC点が図1と同じ臨界点で、その時の温度を臨界温度、圧力を臨界圧力と呼び、二酸化炭素ではそれぞれ31℃、72気圧、水では374℃、218気圧です。
温度はいいとして、これらの圧力がどの程度のものかはちょっと想像しづらいかもしれません。水圧の場合に例えると、72気圧とは水深720mの圧力であり、218気圧というのは水深2180mの圧力です。太平洋の平均水深が4000mぐらいですから、やや浅めの大洋の海底の圧力、といったところでしょうか。また1cm2当たりにかかる力という観点で言えば、72気圧で約72kg、218気圧で約218kgですから、超臨界水の場合ですと、例えは悪いですが、大相撲の巨漢力士にハイヒールで踏まれたぐらいの圧力、ということですね(痛そう!)。
ところで、図3のA点の気体とB点の液体が両方存在している状態を保ちながら温度を変化させると、A点とB点は図の黒の点線のように動きます。このグラフの横軸を密度に(体積の逆数が密度です)、縦軸を、その圧力が飽和蒸気圧となる温度に書き直すと、図1と同様のグラフが得られるのです(縦軸と横軸の関係は逆ですが)。
超臨界状態を説明するのによく使われるもう一つの図は、温度と圧力を軸にとった、いわゆる状態図と呼ばれるものです(図4)。
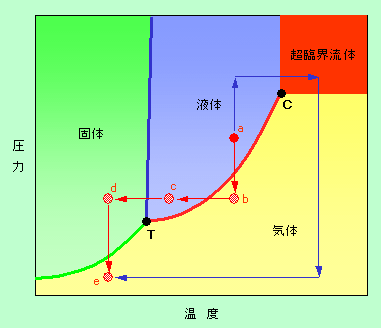
図4 典型的な状態図
この図では、左上の緑色が固体の領域、その右の青色が液体の領域、下の黄色が気体の領域で、ある温度と圧力の物体の状態は、それがこの図のどこに相当するか決まります。といっても漠然と見ていただけではわかり難いので、具体的に例を引いて説明します。
図の中央やや右上にa点として赤丸が描かれています。ここは液体の領域ですから、a点が示す温度と圧力では対象の物質は液体です。ここで、温度は一定のままで圧力を下げてみましょう。液体を閉じ込めた注射器のピストンをゆっくり引っ張ることをイメージすればよいと思います。a点は赤色の矢印のように垂直に下に降りて来て、気体との境界線に達した瞬間に沸騰が始まります。沸騰している間は、ピストンを引っ張り続けても圧力は下がりません。次々に気体が発生して空間を埋めてしまうからです。全ての液体が気化すると、新たな気体の発生はもうありませんから、ピストンを引くに従って圧力は再び下がり始め、やがてb点に達します。
次に、注射器を冷蔵庫に入れて冷やしてみましょう。今度は圧力一定ですからb点から水平に左に動きます。途中で気体と液体の境界線に達し、ここで液化が始まります(この時、体積は急激に減少します)。液化が続いている間は温度は一定に保たれますが、全ての気体が液化してしまうと再び冷却されて、c点に達します。そのままさらに冷却を続けると、ついには固体のd点に達することになります。
最後に、d点から圧力を下げてみます。今度は固体と気体の境界線を通過しますから、ここで固体から直接の気化(昇華)が起こり、最終的には全てが気体となったe点に移ります。境界線上では固体と気体が共存し、その間は圧力が変化しないことはa点からb点への変化と同様です。
3つの曲線が交わるT点は三重点と呼ばれます。ここは、気体、液体、固体の3つの状態が一緒に存在できる唯一の点で、水では0.01℃, 0.006気圧、二酸化炭素では-56.5℃, 5.11気圧です。水の三重点の圧力は大気圧よりも低いですから、図4の大気圧(1気圧)のところに水平線を引くと、青線と赤線の両方と交差します。青線との交点は1気圧で固体と液体が共存する点、つまり融点であり、赤線との交点は1気圧で液体と気体が共存する点、つまり沸点です。ところが二酸化炭素の場合には、三重点の圧力は1気圧より大きいので、1気圧の線は緑線としか交差しません。そのため1気圧では液体の二酸化炭素は存在せず、当然、融点や沸点もありません。緑線との交点(昇華点)で固体(ドライアイス)から直接に気体に変化してしまうのです。
以上、長々と説明して来ましたが、本稿の主題はこれではなく、右上の領域です。液体と気体の境界を示す赤の線が、右上で突然消えてしまうのです。この図だけを見れば唐突なことのように思えますが、図1や図3を見てきた人にはその意味が理解できるでしょう。この赤の曲線は液体の飽和蒸気圧を表す曲線で、図3で言えば、A点とB点を結ぶ破線の部分の圧力を、その時の温度に対してプロットしたものです。臨界温度に達したところで、図3の破線の部分はなくなってしまうので、蒸気圧曲線も終わりになってしまうのです。この終端が臨界点であり、ここよりも高温・高圧の領域が超臨界流体です。超臨界流体を経由すると、これまでとは全く違った状態変化が可能になります。図4のa点からe点に向かう青い矢印を見てください。このルートで温度と圧力を変化させると、途中で境界線を横切ることなく液体を気体に持って行くことができるのです。
超臨界流体というのは、温度が臨界温度以上で、圧力が臨界圧力以上の流体のことです。それでは、どちらか一方だけ、例えば臨界温度よりも高温で、臨界圧力よりも低圧の流体とはどんなものでしょうか。超臨界流体とは言えませんが、温度が臨界温度より高いのですから、図3(f)のように液体/気体の変化を示す破線部分はありません。ということは・・・・・どんなに圧縮しても液化しないのです。図4で言えば、右下の気体状態から右上の超臨界流体に滑らかに変化する、ということで、実は我々の周辺にある空気、これがまさにこの状態なのです。空気の主成分である窒素の臨界温度はマイナス147℃、酸素の臨界温度はマイナス118℃ですから、室温では完全に臨界温度以上。そのため、これらのガスを圧縮だけで液化することはできません(このような状態の気体を「永久気体」と言ったりもします)。液化するにはまず臨界温度以下まで冷やして、その後必要ならば圧縮することになります。
これとは逆に、臨界圧力よりも高圧で、臨界温度よりも低温の状態も当然存在します。今度は、図4からもわかるように、どんなに高温にしても気体にはなりません。このような液体を加熱すると、沸騰することなく超臨界流体になってしまいます。
ところで、超臨界流体が身近なところにある、と言ったら驚きますか? 樽入りのビールを押し出すのに緑色の炭酸ガスボンベを使いますね。あの中には液化した二酸化炭素が入っています。揺らすとチャプチャプ音がしますからすぐにわかります。ところが、夏の暑い日だと気温は30℃を超えます。二酸化炭素の臨界温度は31℃。ということは、真夏の炭酸ガスボンベの中身は・・・超臨界二酸化炭素になっている可能性が高いのです。超臨界流体になると、液面がなくなりますから、もうボンベを揺らしても音はしません。機会があったら試してみてください。
超臨界流体の特異な性質
超臨界というものががどんな状態なのかを温度や圧力の観点で見てきましたが、それではその性質はどうでしょうか。一般に、「気体と液体の中間の性質」だとか、「気体と液体の性質を併せ持つ」とか言われますが、「中間」と「両方」とではずいぶんニュアンスが違いますね。私としては、ある面では中間、ある面では気体に近く、また別の面では液体に近い、というのが正しいのではないかと思っています。それでは、超臨界流体が持つ性質を具体的に見てみましょう。
分子レベルで考えた時に物の性質を表すポイントは、分子の数、分子の動きの速さ、そして分子どうしの相互作用です。分子の数というのはもちろん単位体積に含まれる分子数のことですから、マクロには物質の密度として現れます。当然、気体では少なく、液体では多くなります。分子の動きの速さを表す指標の一つとしては拡散係数というのがあります。水の中にインクを一滴落とすと徐々に広がって(拡散して)均一になって行きます。この広がりの速さを表す数値が拡散係数で、気体の場合は一瞬で拡散がおこりますから非常に大きな値になり、液体の場合には、インクの例でもわかるように、気体と比べてはるかに小さな値になります。分子どうしの相互作用を表すものとしては粘度や表面張力があります。分子間の連絡が密なほど粘度は高くなりますから、液体の粘度は気体の粘度よりもはるかに大きいわけです。これらの値を、気体、液体、超臨界流体で比較したのが図5です。図の横方向は対数で目盛ってありますので、それぞれの値のオーダー(桁数)の比較だと思ってください。

図5 気体、液体、超臨界流体の性質の比較
これを見ると超臨界流体は、分子の数は液体に近く、分子どうしの相互作用は気体に近く、分子の動きの速さは(桁数で見て)中間レベル、ということが言えそうです。液体のように密度が高いのに、粘りがなく気体のようにサラサラしている、ということです。
分子の数が多い(密度が高い)という性質は、色々なものを溶かし込むのに極めて有利です。物が溶けるということは、溶かす物(溶媒)の分子が、溶かされる物(溶質)の分子やイオンを取り囲んでバラバラにほぐす、ということです。ですから、溶媒の分子がたくさんあるほど都合がよいわけで、その点で超臨界流体は液体と同様に他の物を溶かす能力が高いのです。しかも、ただ単に色々なものをよく溶かすだけではありません。もう一度図3の(e)や(f)の曲線を見てください。臨界点の近くでグラフが横に寝ていますね。これは、圧力をちょっと変えただけで密度が大きく変化することを意味します。密度が変われば溶解能力も大幅に変わるわけで、超臨界流体は圧力を操作するだけで溶解性を大きく変化させることができるのです。これは液体には真似のできない芸当です。
サラサラしていて分子の動きも速い、ということは狭いところにもすぐに入り込むことができることを意味します。複雑な形をした機械部品などの隙間にも簡単に入り込みますし、それよりもはるかに小さな、それこそ分子レベルの小さな孔(例えばシリカゲルや活性炭のような多孔体の微細な孔)にも気体と同じように出入りできます。
超臨界流体の特徴はこれだけではありません。分子間の相互作用が弱く動きが速いということから、気体と同じように、他の超臨界流体や気体と自由に混合する、というのもその一つです。例えば、超臨界状態の水は酸素とも完全に混ざるので、超臨界水に酸素を混ぜて、その中で物を燃やすことだってできるのです。また、超臨界状態にすることで液体の時とは全く違った性質を持たせることができる場合もあります。水の場合、水分子がイオン化する割合や、電場の中で向きを揃える性質(誘電率)に大きな変化が見られることはよく知られています。
混合物も超臨界状態になる
これまでの話は、水だけ、とか二酸化炭素だけ、といった純物質が対象でしたが、超臨界流体というのは何も純物質に限ったものではありません。ここで混合物の場合について少し説明しておくことにします。ただし、成分の数が増えるとややこしいので、2成分の系に限定します。
図4の状態図では、変数は温度と圧力の2つだけでした。ところが成分が2つになると、これに組成という変数が加わって3次元になります。当然、状態図も3次元表示しなければならないのですが、いきなり3次元ではわかりにくいと思いますので、まずは温度を固定して、組成と圧力の2次元で見てみましょう。図6は(液体状態で互いに混ざり合う)一般的な2成分系の「組成-圧力」図です。横軸が組成を表し、右端がA成分100%、左端がB成分100%に相当します。縦軸は圧力で、図の黄色の低圧領域では全体が一様な気体、青色の高圧領域では一様な液体、そして真中の凸レンズ状の白色領域では気体と液体の両方が存在しています。この図でA成分100%の時とB成分100%の時とを比べると、B成分100%の時の方が蒸気圧が低いですから(図のA点とB点で、B点の方が低いところにある)、B成分の方が液化しやすい物質と言えます。例えば、A成分が二酸化炭素でB成分がアルコール、というような組み合わせです。
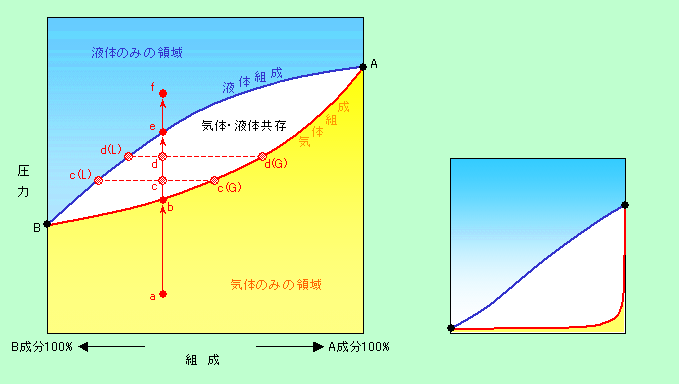
図6 普通の2成分系の状態図
ここで、図に赤丸で示したa点から圧力を徐々に上げて行くことを考えましょう。a点ではA成分とB成分は完全に混ざり合った気体の状態です。これを圧縮してb点に達すると液化が始まり、c点、d点と液化が続きます。この時に発生する液体の組成は、元のa点とは違っています。例えばc点では、そこから左に水平線を引いて青線とぶつかるc(L)点の組成の液体ができるのです。先ほど書きましたようにB成分の方が液化しやすいので、B成分をより多く含んだ液が出て来る、と考えればよいでしょう。その結果、気体中ではB成分が不足しますから、気体の組成は、c点から右に水平線を伸ばして赤線とぶつかるc(G)点の組成に変化します(つまり、赤線は気体の組成を、青線は液体の組成を表す線だということです)。さらに液化が進んでd点になると、液体の組成はd(L)、気体の組成はd(G)と、全体にA成分の比率が高まって行き、e点に達したところで気体がなくなって全て液体となるのです。この時点で液の組成は元のa点と同じ状態に戻っています。逆にf点から圧力を下げて行くと、全く逆の過程を辿ります。e点に到達した後、初めはA成分を多く含んだ気体を発生し(例えば炭酸水から二酸化炭素が泡になって飛び出すように)、B成分主体の液体(例えば気の抜けた炭酸水)を残します。最終的にはb点で(水も全て蒸発して)完全な気体となり、a点(二酸化炭素と水蒸気の混合ガス)に戻ることになります。
ところで、図6のように気体・液体の共存領域が凸レンズ型になるのは、2つの成分の性質が比較的近い場合で、2成分の性質が、水と二酸化炭素、アルコールと二酸化炭素のように大きく違っていると、実際の状態図は右に小さく示したような形になります。炭酸水などを例にして凸レンズ型の状態図の説明をしましたが、これはあくまでも便宜上のものと思ってください。
それでは、「普通でない」場合の状態図はどうなるでしょうか。温度を上げて行くと、図6の状態図が図7のように変わるのです。
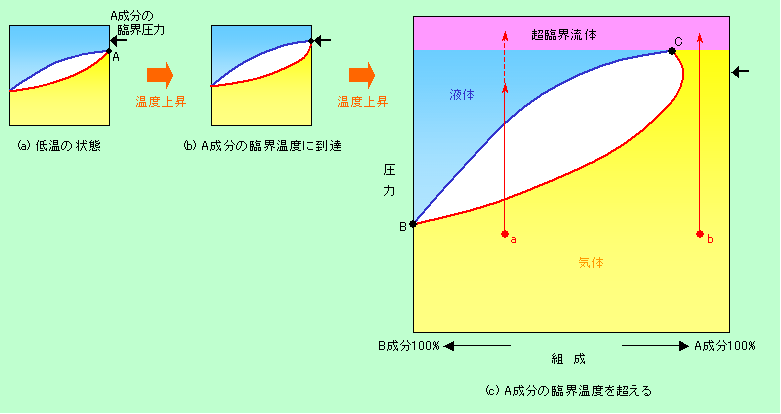
図7 温度を上げた時の状態図の変化
図7(a)は温度が低い状態で、図6と同様にA点はA成分100%の時の蒸気圧です。温度を上げてA成分の臨界温度に達すると、図7(b)のように、A成分の蒸気圧は臨界点に一致します(圧力が臨界圧力になります)。ここまでは普通の状況です。ところがA成分の臨界温度を超えると液化しなくなりますから、A点に相当する点もなくなってしまいます。この現象は、「組成-圧力」図では、図7(c)のように赤の線が右端から離れる、という形で現れます。
図7(c)に赤丸で示したa点の場合、そこから圧縮して行くと、図中の赤矢印のように、赤線を横切って気体・液体の共存領域を通過し、最後に青線を横切って液体領域に入ります。この状況は、図6の普通の場合と何ら変わりありません。途中でB成分を多く含んだ液体が生成し、気体はA成分に富むようになり、そして最終的には全てが元と同じ組成の液体になるのです。これに対してb点の場合は全く様子が異なります。途中で赤線も青線も横切ることなく、高圧領域に入ってしまうのです。これは、「臨界温度よりも高い温度にある気体を圧縮すると液体になることなく超臨界流体になる」という現象と同じです。2成分においても純物質の時と同じ現象が見られるのです。
それでは、どこから上を「超臨界流体」と呼んだらよいでしょうか。A成分単独、B成分単独の臨界点は、あまり関係なさそうです。その代わりに、図7(c)にはC点という特異点が出現しています。この点よりも高圧になると、組成をどんなに変えても、気体・液体が共存する白色領域には入りません。つまり、あらゆる組成で均一の流体となるのです。というわけで、混合物の場合には、C点を超える高圧領域を超臨界流体と呼ぶのが適当でしょう。そしてC点がこの系の臨界点、ということになります。純物質の場合には臨界点(臨界温度・臨界圧力)は物質によって決まっていました。しかし混合物の場合には、温度、圧力、組成のうちのどれか一つを指定してやらなければ、臨界点は決まりません。例えば、図7のように温度によって状態図の形は変わりますから、温度を一つに決めることで初めてC点の位置、つまり臨界圧力と臨界組成が決まります。あるいは、組成を一つに決めることで、その組成が臨界点になる温度と、その時の圧力が決まるのです。
さて、いよいよ3次元表示です。図4の温度軸、圧力軸に加えて、画面に垂直な方向に組成軸が加わります(図6や図7に温度軸が加わるとも言えます)。その状態図は図8のようなものになります。この図では、気体・液体の共存領域をピンク色の立体で示しました。
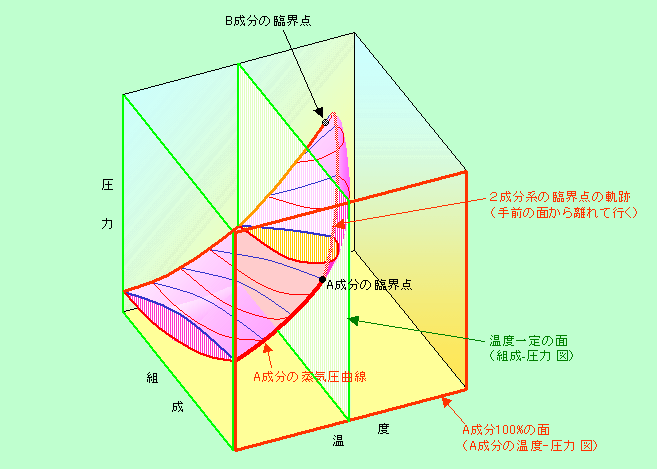
図8 3次元表示の状態図
図の立方体の緑で囲った面(およびそれと平行な全ての断面)は、温度が一定の時の「組成-圧力」図に相当します。左側面は図7(a)、真中付近の断面は図7(c)と同じ形になっていることがわかると思います。一方、手前の赤で囲った面はA成分100%の時の「温度-圧力」図、つまり図4の状態図になっています(固体に関係する部分は図8には表示されていません)。ピンク色の立体が手前の面に接するところがA成分単独の場合の蒸気圧曲線(赤の太線)になるのです。ところが、ピンク色の立体は、温度がA成分の臨界温度よりも高くなると、手前の面まで届かなくなりますから、この蒸気圧曲線はA成分の臨界点のところでプッツリ切れてしまいます。図4では唐突に蒸気圧曲線が無くなっていましたが、このように組成も含めて3次元で考えると、線が消えるのではなく、2成分系の臨界点に姿を変えて奥の方へ引っ込んでいるだけであることがわかります。そして2成分系の臨界点を辿って行くと、立方体の中を通って、向こう側の面でB成分の臨界点につながっているのです。
このような臨界点の軌跡の形は、物質の組み合わせによって様々に変化しますので、いつも図8のような形になるとは限りません。
超臨界流体は何に使えるか
上で挙げたような特徴を活かして、様々なところで超臨界流体が使われ始めています。もっともどんな物質でも、というわけではなく、実際に使われているのは安くて安全な二酸化炭素や、性質が劇的な水、その他一部のアルコールぐらいです。以下に、応用例を簡単に挙げておきましょう。
成分の抽出
「奥まで入り込む」という性質と「物をよく溶かす」という性質を利用して、主に固体状の物質から特定の成分を抽出することに利用されています。この分野で活躍しているのはほとんどの場合二酸化炭素で、これにちょっとだけハナ薬(溶解を助ける有機溶媒など)を加えることもあります。装置の構成はおよそ図9のようで、対象物を入れた高圧容器にポンプで超臨界流体を連続的に送り込み、出口側で圧力を下げることで取り出した成分を分離します。
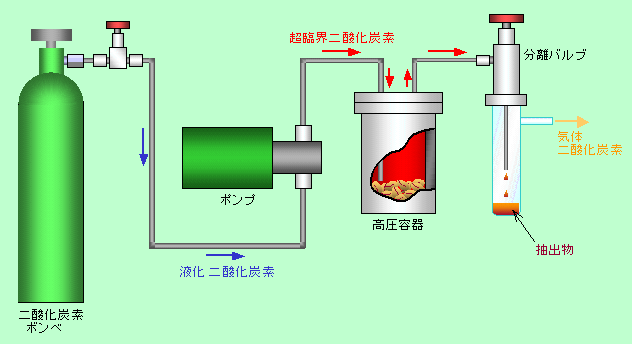
図9 超臨界流体を利用した抽出装置
身近な例としては、コーヒー豆からのカフェインの除去があります。加熱したのでは大事な香り成分なども一緒に出てしまいますし、食品に対して有機溶媒を使う、というわけにも行きませんから、超臨界二酸化炭素は重宝です。圧力や温度をうまく調節してやれば、香り成分を損なうことなくカフェインだけを取り出すことができ、しかも最後に圧力を下げるだけで二酸化炭素は飛んで行ってしまいますから、後で洗う必要もありません。同じように、ポテトチップスから油分を取り除くのに使われているという話も聞いたことがあります。
上の2つの例は不要成分を取り除く話でしたが、逆に有用成分を取り出すことにも利用できます。例えば、植物から特殊な香り成分や薬用成分を取り出す研究は盛んに行なわれています。ただし、二酸化炭素の場合は温度も圧力も大したことはありませんが、それでも家庭用の圧力鍋の比ではありませんから、抽出装置にはそれなりにお金がかかります。ですから実用化ということになると、どうしても化粧品や薬などの付加価値の高いものに限られるようです。
洗浄
余分なものを溶かし去る、という点では、いろいろな物の洗浄にも使えます。半導体の製造プロセスで、基板の洗浄や薬剤の除去に使われる例があり、その他、複雑な形をした機械部品を洗うのにも利用されています。装置の構成は図9の抽出装置とほとんど同じです。
洗浄の用途で少し違った例としては、衣類のクリーニングへの利用があります。よく町で「ドライクリーニング」という看板を見かけると思いますが、これは普通は水の代わりに有機溶剤を使うクリーニング法のことで、決して本当の意味の「乾いたクリーニング」ではありません。これに対して超臨界二酸化炭素を使ったクリーニング技術が開発されています。こちらは、「液体」は使いませんし、取り出した時点で洗濯物は完全に乾いていますから、正真正銘の「ドライ」です。やはり装置に費用がかかりますから、どのくらい普及するかは未知数ですが、ドライクリーニング用の溶剤に環境保護の面で問題がある物が多いことを考えると、今後利用が本格化するかもしれません。
廃棄物処理
今度は超臨界水の出番です。超臨界二酸化炭素が非常に不活性でほとんど化学反応はしないのに対して、超臨界水、あるいはその一歩手前の亜臨界水は「超」が付くほど活性です。特に酸素などの酸化剤を含んだ超臨界水中ではほとんどの有機物が即座に分解してしまいますから、通常は分解しにくい有害物質、例えばPCBやダイオキシンも効率よく分解することができるのです。ならばすぐにやればよい・・・ということになりそうですが、厄介な問題があります。あまりに活性が高いので、容器や配管までやられてしまうのです。ステンレス製の容器やバルブ類はすぐにダメになりますから頻繁に交換が必要ですし、ニッケルやチタン系の合金を使えば寿命は大幅に伸びますが、これらは非常に高価です。このような事情があるので、なかなか採算が合わず、民間企業が参入して来ないのです。それでも、なにせ「水」ですから、そのものの安全性は文句なしです。今後に期待、というところでしょう。
この他に、廃プラスティックのリサイクルにも用いられます。プラスティックを構成する長い分子を超臨界水中で分解して、元の小さな分子にしてしまおうというわけです。これらはまた新しいプラスティックの合成に使われ、リサイクルされるのです。資源の有効利用が叫ばれている昨今ですから、少々割高でも、これらの技術が活用されるようになるかもしれません。
化学反応
先ほどの有機物の分解も化学反応の一種ですが、単なる分解だけでなく、超臨界流体の中でいろいろな化学合成が試みられています。特異な性質を持つ超臨界流体ですから、その中では普通の条件では起きないような反応が起こる可能性があるのです。また、有機合成だけでなく、超臨界二酸化炭素を媒質とした無機合成もあります。超臨界二酸化炭素には普通の無機物(金属やその化合物)は溶けにくいのですが、金属の周りを有機物が取り囲んだような化合物を使えば溶かすことができ、無機の粉末や薄膜が合成されています。
特殊な乾燥
濡れたものを乾かす時は、普通は液体を気体に変えて飛ばします。ところが、この乾燥過程で、いろいろと都合の悪い現象が起こることがあります。濡れた地面が乾いた時に、ひび割れが入っている様子を見たことがあるでしょう。紙粘土できれいに工作したのに、乾かしたらひびだらけになってしまった、という経験はありませんか。液体状態の水は分子どうしが引き合うことによる強い表面張力を持っています。そのため、図10(a)のように残り少なくなった水分が土や粘度を自分の方に強く引き付け、ひびが入ってしまったのです。
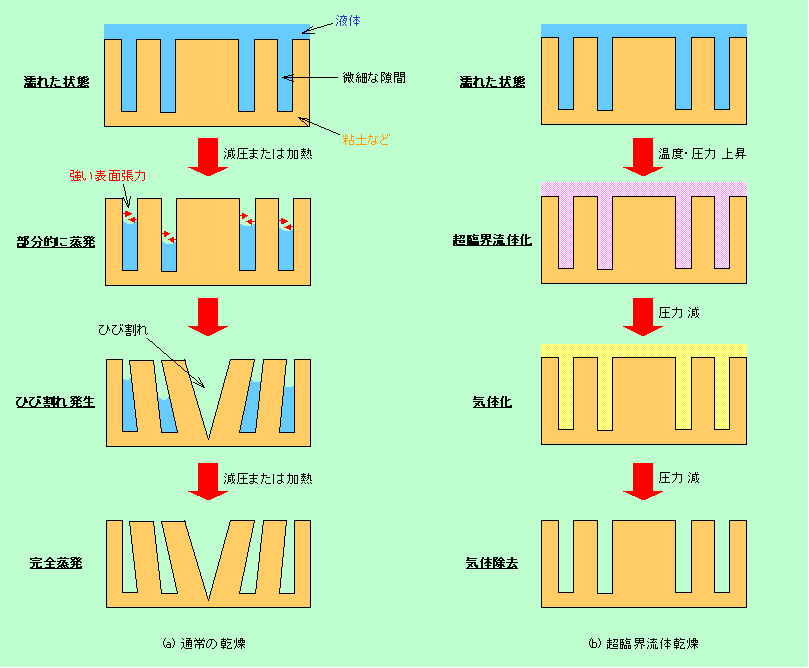
図10 ひび割れを起こさない、超臨界流体を利用した乾燥法
超臨界流体の性質を利用すると、このようなひび割れを防いで乾燥させることができます。超臨界流体は分子間の相互作用が弱く、表面張力は非常に小さくなっています。そこで、図4の青の矢印で示した経路に従って超臨界流体を経由して気化させると、途中で強い表面張力が働くことはありませんから、ひびが入らないのです(図10(b))。
さすがに紙粘土細工に超臨界流体を使うわけには行きませんが、微細な孔を大量に持ったシリカの板をひび割れなしに乾燥させる場合などに応用されています(この場合の液は水ではなくアルコールですが)。
余談
超臨界流体について簡単に紹介してきましたが、最後に余談を一つ。
「超臨界」という言葉は英語で“supercritical”と言います。同じく“super(超)”という語を冠したものに“superconductivity(超伝導)”や“superfluidity(超流動)”がありますね。“superman(超人)”なんていうのもありました。これらの“super(超)”というのは“normal(常)”の反対で、「より優れた」「超越した」という意味合いが強いでしょう。ところが、“normal(常)”には別の反対語もあります。“abnormal(異常)”です。こちらはあまりよい意味では使われません。“normal”の反対には、“super”と“abnormal”という、全く印象の違う2種類の言葉があるのです。
ですが、“super”と“abnormal”は全く別物でしょうか。世の中で今でこそ“super”と呼ばれる技術でも、初めて登場した当時は“abnormal”とされて白い目で見られたものがたくさんあります。“abnormal”大いに結構。“abnormal”から“super”を目指しましょう。将来、大化けするかもしれませんよ。
雑科学ホーム
hr-inoueホーム










