
雑科学ホーム
hr-inoueホーム
● 染料・顔料の話 ●
色を付ける材料
世の中は様々な色で溢れていますが、
色の話にも書いているように、これらの色は光の波長を反映したものです。人間の目には、異なる波長の光に反応する3種類の物質が含まれており、その組み合わせによって、様々な色を感じているのです。目という器官が、波長の違いを色の違いとして認識するようにできている、と言うこともできるでしょう。
このような「色」を作り出す方法には2種類あります。一つは、様々な波長の光を発する方法。もう一つは、特定の波長の光を吸収する方法です。光を発するにはエネルギーが必要で(光もエネルギーですから)、そのためには電気や熱や、他の光の力を借りなければなりません(
発光の話参照)。これに対して「吸収」の方は、既にある光の中から適当な成分を吸い取ってしまえばいいわけですから、新たなエネルギーは不要です。本稿の主題である「染料」や「顔料」は、まさにこの「吸収」を利用して色を作り出す材料なのです。
もっと広く「色素」という言い方をすれば、植物の葉緑素なども含めて、世の中の「色の素」すべてをカバーすることになるでしょう。しかしこれでは範囲が広すぎますので、ここでは「いろいろなものを着色するための材料」ということで話を進めることにします。いわゆる絵の具やペンキの類だと思ってもらえばよいでしょう。とは言っても、その中には天然物から採れるものもあれば、化学合成されるものもありますし、有機物もあれば無機物もあり、その性質や使われ方も多種多様です。これらの染料・顔料の種類の話に深入りするとキリがありませんので、そのあたりは専門の本やサイトを見ていただくとして、この記事では染料や顔料が色を出すしくみを中心に見て行くことにします。
色の基本は3原色
3原色の話は
色の話にも詳しく書いていますが、基本中の基本なので、ここでも簡単に取り上げておきましょう。まず光の3原色ですが、人間の目はそれぞれ異なる波長の光に反応する3種類の感光物質を持っており、その波長によって3原色が構成されています。言わずと知れた、赤(R)、緑(G)、青(B)です。そして、赤と緑が混ざるとイエロー(Y)に、緑と青が混ざるとシアン(C)に、そして青と赤が混ざるとマゼンタ(M)になり、3色全部が混ざると白(W)になります。光ですから、たくさん混ざるごとにどんどん足し合わさって明るくなり、最後には全ての波長を含んだ状態と同じ、白色になるのです(図1(a))。
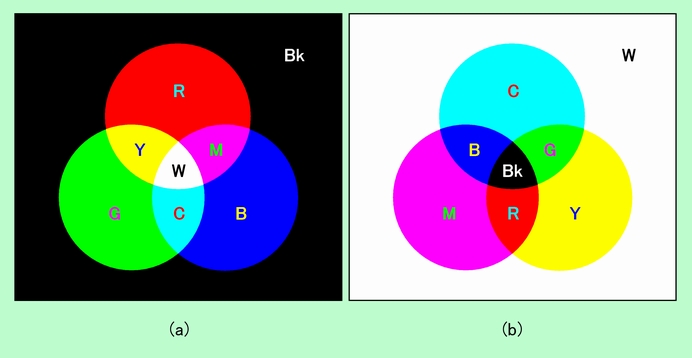
図1 光の3原色と色の3原色
これに対して、自分自身で光を発しない大部分の物質の色は、他からやって来た光のうちの特定の成分を吸収し、残りを反射することによって作られます。そのため、この場合の基本色は、「赤を吸収した色」と「緑を吸収した色」と「青を吸収した色」の組み合わせになります。赤を吸収するということは、全ての波長を含む白い光から赤だけを除く、ということです。その結果、残りの反射光は緑と青を混合した状態と同じになって、図1(a)の緑と青が重なった部分に現われるシアンが見える、ということになります。同じように、緑を吸収するとマゼンタに、青を吸収するとイエローになりますから、色の3原色は、図1(a)の2色を混ぜた部分に現われる色の組み合わせ、即ち、シアン(C)、マゼンタ(M)、イエロー(Y)となるのです。このような、赤-シアン、緑-マゼンタ、青-イエロー の関係を「補色」と呼ぶことは、
色の話にも書いている通りです。
それでは2色を混ぜ合わせた部分には、どんな色が現われるでしょうか。例えばマゼンタとイエローを混ぜることを考えてみましょう。マゼンタは白色光から緑を除いた色、イエローは白色光から青を除いた色ですから、この両者が混ざると、白色光から緑と青が除かれることになり、結局、赤が残ります。つまり、マゼンタとイエローを混ぜると赤が現われるのです。同様に、イエローとシアンを混ぜると緑、シアンとマゼンタを混ぜると青になりますから、色を2種類混ぜた部分には、ちょうど光の3原色それぞれが現われることになるのです。また全ての色が混ざると、全部の光を吸収してしまいますから、光がなくなって真っ黒(Bk)になります。光の混合が足し算(加法混色)であったのに対して、色の混合は引き算(減法混色)、ということですね。こうして図1(b)の色の組み合わせができ上がるのです。なお図の円の外側の部分は、(a)の光の場合は、足し算する前の何もない状態なので黒(Bk)、(b)の色の場合は、引き算する前の全ての光が揃った状態なので白(W)になります。
---------------------------------------------------------------------
子供向けの本などで、色の3原色は「赤」「青」「黄色」と書いてあるのを見ることがあります。色を厳密に区別しなければ、マゼンタは赤、シアンは青と呼べなくもありませんが、どんなものでしょうか。確かに、そんな細かい話は不要、という意見もあるでしょう。しかし、「どうして光の3原色の中の緑だけが黄色に替わるのか」が理解できずに悩んだ覚えがある身としては、初めから「実は3色すべて違う」という説明をしてもらった方がよかったのに・・・・、と思ってしまいます。
---------------------------------------------------------------------
光の吸収は、発光の反対
物に色が付いて見えるのは、特定の波長の光を吸収するためである、ということがわかったところで、次に「光の吸収」という現象そのものに目を向けてみましょう。光はエネルギーですから、光を吸収するということは、エネルギーをもらう、ということです。エネルギーをもらえば、当然その物質が持つエネルギーは増えなければなりません。この時、増えたエネルギーを保持できる状態をその物質が備えていれば、光の吸収はちゃんと成立します。ところが、高いエネルギーを収める状態が存在しなければ、光は吸収されません。逆に言えば、高いエネルギー状態を収める体制が整っている物質ならば、そのエネルギー差に相当する光を吸収できる、ということです。このことを模式的に示したのが図2です。
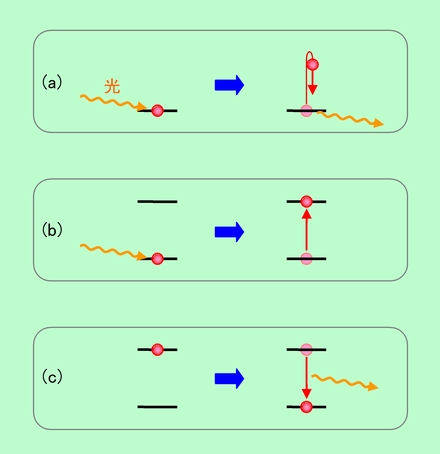
図2 光の吸収と発光
その物質のエネルギーの状態は、赤い玉の位置で表されます。赤い玉が低い位置にいる時はエネルギーが低い状態(基底状態)、高い位置にいる時はエネルギーが高い状態(励起状態)です。図2(a)で、初め低い位置にいた赤玉に光がぶつかって来たとします。赤玉は光のエネルギーを受けて飛び上がろうとしますが、誰も受け止めてくれないので、飛び上がることができません。結局、光はそのまま通り抜けるか、反射して戻って行くしかありません。
これに対して図2(b)では、光を受けた赤玉が、高い位置にある別の座席につかまって落ちて来ません。高いエネルギー状態が保持されたのです。この場合、光はエネルギーを完全に失ってしまい、もう戻っては来ません。これが、光が物質に吸収された状態です。この時の光のエネルギーは、赤玉をちょうど上の座席の高さまで弾き飛ばす大きさでなければなりません。エネルギーが足りないと座席まで届きませんし、逆にエネルギーが大きすぎてもダメです。実際の光の吸収で言えば、受け側にピッタリ合ったエネルギーを持った光(つまり、特定の波長の光)だけが吸収される、ということです。
これとちょうど逆になるのが、図2(c)の
発光の過程です。初めに高い位置にいた赤玉が、何らかの拍子に落ちて来て光を放出するのです。当然ながら、赤玉の落差に相当するエネルギーが光に変わることになりますから、物質側のエネルギー差によって、出て行く光の波長も決まります。(b)と(c)では物質側のエネルギー差は同じですから、(b)で吸収される光の波長と(c)で放出される光の波長は同じになるのです。
それでは、ここで言う「赤球が飛び上がるエネルギー差」は本当はどのようなエネルギーに対応しているのでしょうか。これは、
発光の話にも書いているように、原子・分子の振動・回転などのエネルギーや、電子のエネルギーに対応しています。これらのエネルギーは、自由にどんな値でもとれるわけではなく、ある決まった飛び飛びの値しかとることができません(
化学結合の話や
量子論の話などに詳しい説明があります)。光を受け取ることで、振動の状態や電子の状態が、エネルギーの低い基底状態からエネルギーの高い励起状態に飛び上がるのです。ただし、原子・分子の振動や回転のエネルギー変化は小さいので、普通はマイクロ波や赤外線しか吸収したり放出したりすることはできません。よほど高温に、それこそ何千度にもなって初めて可視光線が出るようになる程度です(
色の話参照)。一方、電子のエネルギー変化の方は、たいてい可視光線から紫外線の領域にあります。ですから「物に色が付く」という現象は、ほとんどの場合、主として電子のエネルギー状態の変化による、と考えてよいのです。
それでは、電子のエネルギー状態の変化による発光と光吸収の例を見てみましょう。図3は原子状の水素の発光と光吸収の様子を、光を波長ごとに分解したスペクトルで示したものです。原子状水素は、強烈な加熱や放電を利用して励起状態にすると、図3(a)のような特定の波長の光を出します。これが水素の発光スペクトルです(
化学結合の話にも同様の図があります)。逆に基底状態の水素に白色光(全ての波長を含んだ光)を当てると、特定の波長の光が吸収されて、通過して来た光に図3(b)のような暗いスジが現われます(吸収スペクトル)。そしてその暗いスジの波長は、発光の位置(波長)とピッタリ一致するのです。
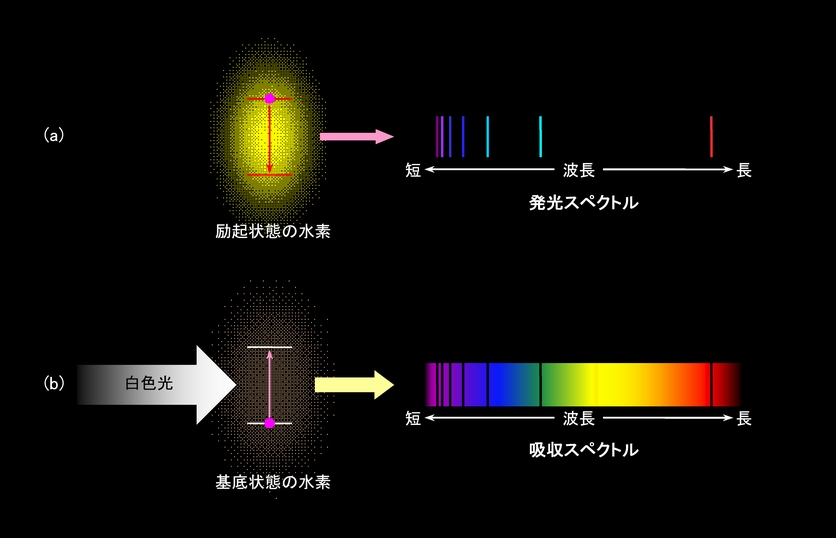
図3 水素の発光スペクトルと吸収スペクトル
さて、図3(b)の原子状水素は何色に見えるでしょう。青領域の吸収が多いから、赤っぽく見えるのでしょうか。
答は「無色」です。図3のようなスペクトルにすれば確かに一目瞭然なのですが、全体の中で一つや二つの波長が抜けていても、人間の目はこれを感知することができません。「650nmの赤い光は含まれているが、656nmの赤い光は含まれていない」などということは、とても判断できないのです。つまり、このような鋭い吸収をポツリポツリと持つような物質は、人間の目には「無色」にしか見えないのです。このいい例が太陽光線です。太陽光線のスペクトルを調べると、様々な元素に対応した多くの吸収線があることがわかるのですが、実際の太陽光線には特定の色は付いていません。
幅広い吸収が色を作る
人間が色を感じるためには、図3(b)のような鋭い吸収ではなく、もっと幅広く、ある波長附近の光をごっそりと取り去ってしまうことが必要です。何やら難しそうですが、実は、単独の原子ではなく、原子をつないで分子にしたり、多数の原子を集めて液体や固体状態にすることで、このような吸収の幅を広げることが可能になります。その様子を図4に示しました。
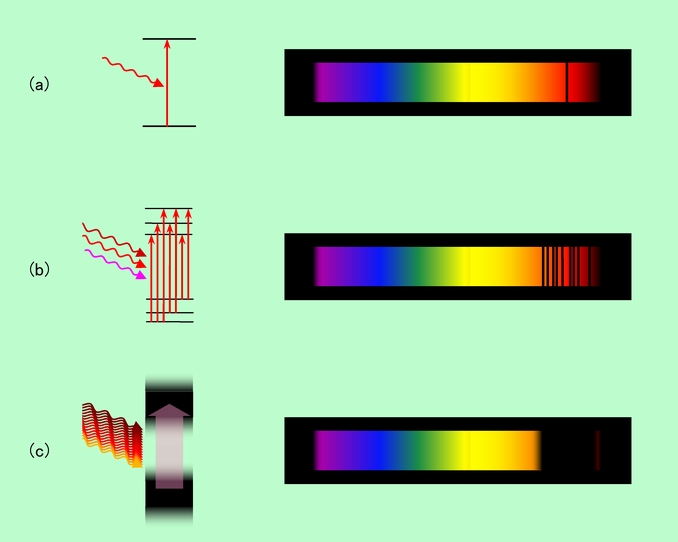
図4 原子が集まると吸収の幅が広がる
複数の原子がつながると、原子一個だけの時と違って、振動や回転などの複雑な運動が起こるようになります。2個の原子間の距離が伸び縮みしたり、3個の原子が作る角度が変化したり、ある結合を軸にして原子の集団がグルグル回ったりと様々なパターンがあり、それぞれが運動の激しさに応じていろいろなエネルギーを持ちます(このエネルギーも飛び飛びになっています)。そして光を吸収する時には、これらの振動や回転のエネルギー状態も一緒に変化しますから、分子のエネルギー状態は原子一個の時の単純な形(図4(a))ではなく、図4(b)のように微妙に違った多くの状態の寄せ集めになります。
原子がたくさん集まった時には、また別の効果も起こります。各原子のエネルギー状態がお互いに影響し合って、元々一種類であった状態がいくつかに分かれて来るのです。結果的に、やはり図4(b)のように多くの状態の寄せ集めができ上がります。
図4(b)の状態になると、もはや吸収できる光の波長は一種類だけには留まりません。赤矢印で示したように、どこから出発してどこに飛び上がるかで、少しずつ違った様々な波長の光が吸収されることになります。さらに分子の構造が複雑になったり、より多くの原子が集まったりすると、エネルギー状態の数も増えて、ほとんど連続的になって来ます。それに伴って、吸収される光の波長もほぼ連続的になり、例えば図4(c)のように赤の領域がごっそりと抜けて、赤の補色のシアン色が見えるようになるわけです。
可視光線を吸収させる方法(有機物の場合)
それでは原子が集まりさえすれば何でもかんでも色が付くか、というと、そんなことはありません。大半の分子や固体、液体が吸収する光の波長は紫外線の領域にあるので、せっかく幅広い吸収を起こしても、色付いては見えないのです。空気や水はもちろんのこと、実験室の試薬棚に並んでいる薬品のほとんどは、アルコールもエーテルもケトンも、パラフィン類も、ベンゼンなどの芳香族化合物も、また多くの無機物質も、ほとんどが無色です。そんな中で染料や顔料となる材料と言うのは、光吸収が可視光線の領域に入って来るそれなりの理由をちゃんと持っているのです。
まず有機物を見てみましょう。多くの有機物は紫外線を吸収するのですが、同じ紫外線と言っても、そのエネルギー(波長)にはずいぶん幅があります。可視光線からは遥かに離れた波長の短い紫外線しか吸収しない、それこそ箸にも棒にもかからない物質もあれば、可視光線よりもほんの少しだけ波長が短い紫外線を吸収できる「惜しい」ものもあるのです。この「惜しい」ものの代表例が、ベンゼン環(例の亀の甲)や二重結合を持った化合物などです。ベンゼン環や二重結合に関わっている電子は、元々、基底状態と励起状態のエネルギー差が小さいので(
化学結合の話参照)、これらにちょっと細工をしてやると、吸収が可視光線の領域に入って来るのです。
その細工の一つは、ある化合物に別のものをくっ付けて、その作用で電子のエネルギー状態を変化させる、というものです。例えばベンゼンは、そこそこ波長の長い紫外線を吸収できる「惜しい」化合物です。これに硝酸を反応させてニトロベンゼンにすると、もっと波長の長い青色領域まで吸収できるようになり、黄色〜橙色に着色するのです。ただし、可視光が吸収できるようになると言っても、やはり大部分の吸収は紫外線の領域です。吸収の裾がわずかに可視光の領域に入っている程度ですから、それほど強く着色するわけではありません。もっとしっかり色を付けるには、さらに別の細工が必要です。
そこで登場するのが、ベンゼン環や二重結合をたくさん連ねる、という方法です。このようにすると、分子中の電子がより広い範囲に広がって存在できるようになります。その結果、基底状態のエネルギーが少し高くなる一方で、励起状態のエネルギーは逆に低く(つまり安定に)なり、より低いエネルギーの光を吸収できるようになるのです。その例として、図5に、ベンゼン環を2個、3個とつないで行った時に、吸収する光の波長がどのように変化するかを示しました。
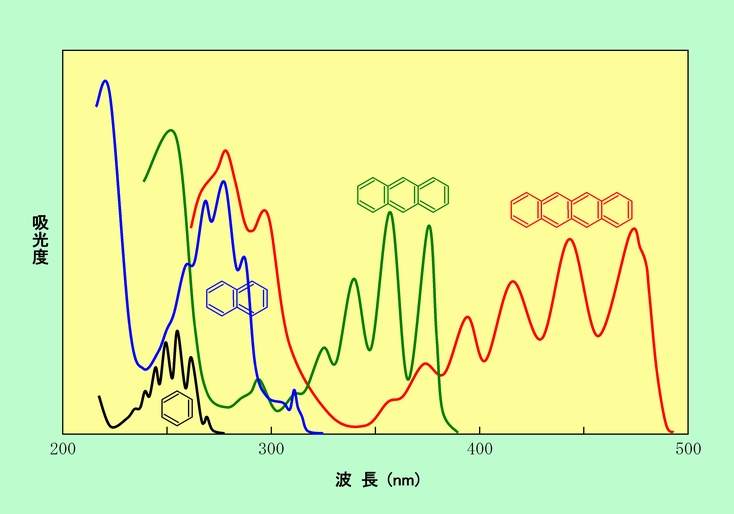
図5 ベンゼン環をつないで行くと吸収波長が変化する
黒で示したベンゼンの場合は、吸収する光の波長はすべて紫外線の領域にあります。これが2個連なってナフタレン(青で表示)や、3個連なってアントラセン(緑で表示)になると、吸収波長がしだいに長くなって来ますが、それでもまだ400nmに届かず、色は付きません。しかし、ベンゼン環が4個連なってテトラセン(赤で表示)まで来ると、400nmを超えて青色の領域まで吸収が伸びるので、青の補色の黄色に色付いて見えるようになるのです。
たいていの有機色素は、このようにベンゼン環や二重結合をたくさん含んだ構造をしています。図6はその代表的な例です。
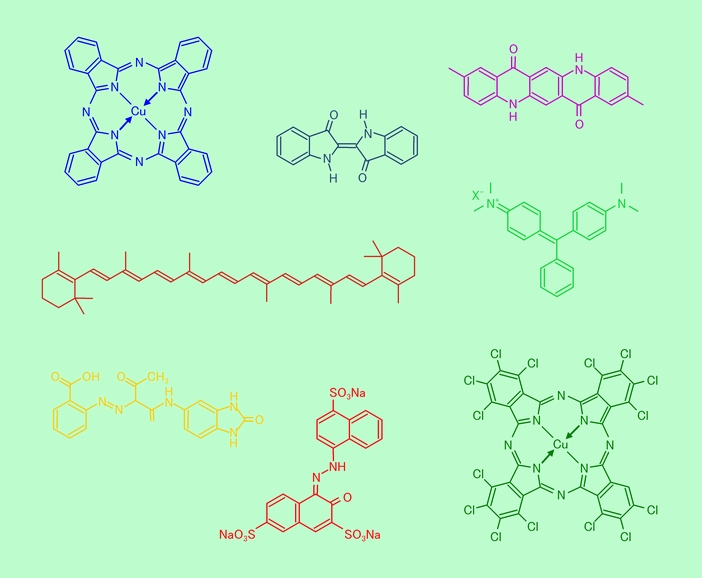
図6 有機色素いろいろ
有機色素は、構造をちょっと変えるだけで色がガラリと変わります。例えば、図6の左上は代表的な青色顔料の銅フタロシアニンですが、これに塩素を付けて右下のようにすると、色が緑に変わるのです。
以前は、発色の元になる構造を「発色団」、これに補助的に働いて色を変えたり強めたりする部分を「助色団」などと呼んでいました。先に書いた二重結合の部分などが「発色団」で、発色団を持つ基本骨格にくっ付いた、窒素を含む原子団などが「助色団」というわけです。しかし現実には、どこかの部分が色を作り、どこかの部分がそれを助ける、というのではなく、分子全体の電子の状態が発色を決めるわけですから、このような区別が厳密にできるものではありません。それでも便利な考え方ではあるので、光を吸収するのに主に関わる部分と、その電子状態を変化させる部分、という意味で、「発色団・助色団」という言葉は今でもよく使われています。
可視光線を吸収させる方法(無機物の場合)
有機物の場合、発色の主役は二重結合やベンゼン環でしたが、無機物の場合の主役は金属です。青色の硫酸銅や赤色の酸化鉄を挙げるまでもなく、いろいろな金属の化合物が色を持っており、天然の鉱石の色も、ほとんどが金属イオンによるものです。しかし金属そのものには、金や銅を除いて、ほとんど色はありませんよね。にもかかわらず様々な発色が起こるのはなぜなのでしょうか。
大雑把に言えば、金属イオンを取り囲んでいる別の原子や分子(「配位子」と言います)の影響で、元々ほぼ同じであった電子のエネルギーに高低の差ができ、このエネルギー差がちょうど可視光線のエネルギーに相当するからです。ただし、どんな電子でもいいわけではなくて、外に向かっていろいろな方向に広がった「d軌道」と呼ばれる軌道に入っている電子に限られます。その意味で、d軌道に電子を持っている「遷移金属」でなければ、この着色は起こりません。また、配位子の種類によってd軌道のエネルギーの高低差も変わりますから、同じ金属でも色が違って来ます。よく知られている金属イオン水溶液の色は、水が配位子として金属イオンを取り囲むことで出ているのですが、例えばアンモニアを加えて水の一部をアンモニアで置き換えるだけで色が変わるのです。(配位子による着色現象はけっこう複雑で簡単には説明し切れませんので、この程度で止めておきます。詳しく知りたい方は「配位子場理論」の専門書を見てください。また「d軌道」に関する説明は、
化学結合の話にも少し書いています)
ところで、これらの金属の化合物を顔料にするには、水のように簡単に蒸発して失われてしまうような配位子では困ります。そこで普通は、酸素などでガッチリと囲まれた金属イオン、つまり酸化物という形で使われることが多くなります。
結晶の話にも出て来るルビーやエメラルドなどの宝石の類も、酸素に囲まれたクロムやバナジウムなどの電子状態が変化することで、あの鮮やかな赤や緑が現われるのです。
この他に、違う種類の金属イオンがお互いに影響しあって可視光線を吸収できるようになる場合や、半導体の性質を持つ化合物が、ちょうど可視光線の領域の吸収を持つ場合(
半導体の話に出て来る「価電子帯」と「伝導帯」の間のエネルギー差がちょうど可視光線のエネルギーになる場合があるのです)などもあります。これらの場合も含めて、表Iに代表的な金属化合物の例を挙げておきましょう。
表I 無機色素(金属化合物)いろいろ
| 一般名 |
およその色 |
主な化学組成 |
| ウルトラマリンブルー |
青 |
Na5Al3Si3O12S |
| プルシアンブルー |
青 |
Fe(III)4[Fe(II)(CN)6]3 |
| セルリアンブルー |
青 |
CoSnO3 |
| コバルトブルー |
青 |
CoAl2O4 |
| アズライト(藍銅鉱) |
青 |
Cu3(CO3)2(OH)2 |
| ヘマタイト(弁柄) |
赤 |
Fe2O3 |
| 鉛丹(光明丹) |
赤 |
Pb3O4 |
| カドミウムレッド |
赤 |
CdS-CdSe |
| 辰砂 |
赤 |
HgS |
| ゲーサイト(黄酸化鉄) |
黄 |
FeOOH |
| カドミウムイエロー |
黄 |
CdS |
| クロムイエロー(黄鉛) |
黄 |
PbCrO4 |
| ジンクイエロー(亜鉛黄) |
黄 |
ZnCrO4 |
| ビリジアン |
緑 |
Cr2O3 |
| マラカイト(孔雀石) |
緑 |
Cu2(CO3)(OH)2 |
| エメラルドグリーン |
緑 |
Cu4(CH3COO)2(AsO2)6 |
染料と顔料の違いは?
上に挙げた例を初めとして、着色に用いる色素の類は、通常は固体の粉です。このままでは他の物を着色するのに都合が悪いので、普通は水などの溶媒に溶いてペースト状にしたり、もっとサラサラの液体状にして使います。この時、溶媒に溶けて溶液になっているのが「染料」で、溶けずに固体の粒子として分散しているのが「顔料」、というのが一般的な染料と顔料の区別のしかたです。ところが、このような定義ではどうにも具合が悪いケースも出て来ます。例えば「分散染料」。これは名前の通り「分散」させて使う染料ですが、溶けずに分散していて、それでも「染料」とは・・・・。どうやら、「溶ける」「溶けない」とは違った区別のしかたを考えなければならないようです。ここでポイントとなるのが染料の「染」の字、つまり「染める」という言葉です。
顔料の場合、色素の分子が集まった粒子が、塊のままで対象物の上に乗っかって着色します。対象物が紙・布・繊維などの場合には、その隙間に潜り込んだりもしますが、繊維などと強く結び付いているわけではありません。図7左に、この様子を模式的に示しました。
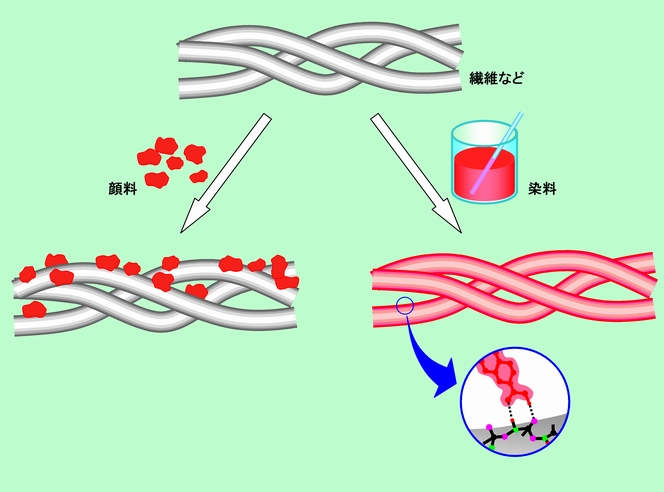
図7 染料と顔料は着色のしくみが違う
これに対して図7右の染料の場合には、色素の分子が塊にならず、1個1個がバラバラになって繊維の表面などにほぼ均等に付着します。その時、図の下の丸の中に描いているように、染料の分子はただ乗っかっているのではなく、対象物と強く相互作用して結び付いています。化学結合を作るところまでは行かないまでも、酸と塩基の作用だとか、水素結合を作るとか、分子構造に基づく何らかの作用で対象物にしっかりと固定されるのです。これが「染める」ということであり、このような「染める」能力のある色素が「染料」と呼ばれるのです。
染料の分子が対象物に結び付いて染めて行くためには、当然それなりの仕組みを分子が備えていなければなりません。酸・塩基などのイオン性の官能基や水酸基などがこれに当たります。例えば図6の右側中ほどの緑色や下段中央の赤色は典型的な染料ですが、たいていの染料はこのようなイオン性の官能基を持っています。また、図6の他の色素は基本的には顔料ですが、同じような官能基を付けることで染料として使うこともできます。これらの官能基の働きで溶媒に溶けやすくなると同時に、対象物と結び付く能力を持つことができるのです。
個々の分子がちゃんと働くには、初めから色素の分子が1個1個バラバラになっていた方が都合がよいことは言うまでもありません。そのため大半の染料は溶媒に溶けた状態(つまり分子が1個1個バラバラになって溶媒分子に取り囲まれている状態)で使われます。しかし、最終的に個々の分子が対象物を染めて行きさえすればいいわけですから、最初に溶けた状態であることは必ずしも必要な条件ではありません。最初は顔料と同じように塊として乗っかっていて、後から分子がバラけて行ってもかまわないのです(図7の左の状態から出発して、最終的に右の状態になればいいのです)。これが先にちょっと触れた「分散染料」です。もちろん、固体の粒子をバラバラにほぐして行くのは簡単なことではありませんから、分散染料でちゃんと染めるには、高い温度や高い圧力が必要で、手間ヒマがかかります。それでも、元々普通の条件では「溶けない」色素なのですから、一旦染めてしまえば、少々洗っても取れない、頑強な着色ができることになります。
分散染料の話が出たついでに、もう一つ、建染(たてぞめ)染料のことにも触れておきましょう。これもそのままでは「溶けない」染料ですが、ちょっとした化学処理(具体的に言うと「還元」)をしてやると、「溶ける」形に変化して溶液にすることができます(構造が変わっていますから色も変化します)。この溶液を使って染めておき、後から(酸化して)元の形に戻してやると、元の色でしっかりと着色することができるのです。このように分散染料と建染染料は、単純に溶液にして使う普通の染料とは違いますが、対象物を「染める」という意味で、立派な染料の仲間なのです。
染料と顔料の違いがはっきりしたところで、それぞれの特徴を少し見て行くことにしましょう。まず対象物への付着性ですが、これは図7でも示したように、染料に分があります。ただし、官能基などで対象物に結合して行くわけですから、官能基の種類や染料の構造によっては、染めるのに適したものや適さないものが出て来ます。例えば、スルホン酸などの酸性の官能基を持つ染料は蛋白質を含んだ羊毛や絹に適しています。また塩基性の官能基を持つ染料はアクリルなどを染めるのが得意ですし、水酸基を持つ染料は木綿やレーヨンなどのセルロース系の材料に効果的です。しかしこれらの組み合わせを間違えると、ほとんど染まらないという状態になってしまうこともあるのです。これに対して官能基を持たない有機顔料や表Iに挙げたような無機顔料は、対象物の上に色素の塊がただ乗っかっているだけですから、相手をほとんど選ばない反面、あまり強固に付着することはできません。場合によっては、しっかりと固着させるために、樹脂などで固めることも必要になるのです。
色の鮮やかさ、という点でも、染料の方が有利です。染料では分子1個1個が光を吸収しますから、発色の効率がよいのです。また顔料の場合には、粒子の表面で光を乱反射することがあります。この乱反射が起こると、全体に白っぽく見えるようになりますから、スリガラスをかけたように色がくすんでしまう傾向が出て来るのです。さらに、インクジェットプリンターの写真印刷用光沢紙などに印刷する場合、染料ならば内部に浸み込むので表面の光沢が活きますが、顔料では表面に塊が乗ってしまって粗くなり、光沢が失われてしまう、という欠点もあります。
こうして特長を並べると、どうも顔料の分が悪いようですが、顔料には染料にはない決定的な長所があります。色褪せを起こしにくいのです。染料や顔料はその特殊な分子構造や結晶構造によって特有の色を出しているわけですから、構造が何らかの原因で壊れてしまうと、本来の色を失ってしまいます。染料の場合、分子が1個1個バラバラになっていますから、分子が壊れると、その部分の色はなくなってしまうのです。これに対して顔料は、色素の分子が集まって塊を作っていますから、表面の一部の分子が壊れても、まだまだ下に新手の分子が残っています。普段発色に貢献している分子は外側の一部分だけで効率は悪いのですが、いざとなればそれまでサボッていた内側の分子が働いてくれるわけです。特に無機の顔料は、日常的な条件で構造が壊れること自体がほとんどありませんから、それこそ何千年、何万年と元の色を保ち続ける場合もあるのです。
それでは、分子の構造を壊す何らかの原因とは何でしょうか。その一番手は、何と言っても紫外線でしょう。太陽光線は言うまでもなく、人工的な明かりにも、紫外線を含むものは多数あります。この紫外線を吸収すると、色素分子の電子のエネルギーが励起状態に飛び上がります。これがそのまま元の状態に落ちてくれればいいのですが、その途中で分子内の化学結合を切ってしまう場合があるのです。色素ですから可視光線を吸収するのは当然ですが、余計な紫外線まで吸収してしまうと、このようにして自分自身を壊すことにつながるのです。特に赤系の色素では、紫外線の影響は甚大です。赤い色を出すということは、その補色である青系の光をよく吸収する、ということを意味します。つまり波長の短い光を吸収しやすい性質を本質的に持っているわけで、当然、紫外線も吸収しやすいのです。よく屋外の看板などで、強調するためにわざわざ赤色で書いた文字だけがキレイサッパリ消え失せて、訳がわからなくなっているのを見ることがありますね。これなどは正に、赤の色素が紫外線を吸収して壊れてしまった結果なのです。
反応性の高いガスも染料にとっては大敵です。以前にコピー機などからよく発生していたオゾン、石油ファンヒーターや車の排ガスなどに含まれる窒素酸化物(NOx)、硫黄酸化物(SOx)などがその例で、色素の分子と反応して色褪せを起こしてしまいます。また、空気中の酸素が紫外線の影響で活性な状態に変化して、これが色素の分子と反応する、ということも知られています。染料にとってはやっかいな物が、身の回りにはけっこうたくさんあるのです。
顔料のもう一つの長所として、滲みが少ない、ということがあります。乾いた後の水濡れに強い、ということもあるのですが、それだけではありません。染料は溶媒に溶けて浸透するので、図柄を印刷する場合などに、色の境目で隣の領域に染み出す、ということがよく起こります。しかし顔料では、粒子が遠くまで移動して行きませんから染み出しが少なく、境目がシャープになるのです。この特徴は、よりクッキリ感が重視される文字の印刷では特に活かされます。インクジェットプリンターでは2種類の黒インクを備えている機種が多いですが、このうち一方は染料インク、もう一方は顔料インクです。写真印刷用には光沢感のある染料インク、文字印刷にはクッキリ感のある顔料インク、というように使い分けているのです。
綺麗なものには毒がある?
食品を着色するのに使われていた食用色素が、毒性があるということで使用禁止になった、という話を時々耳にします。食用ではない色素でも、何らかの原因で体の中に入ってくることは有り得るわけで、安全性は気になるところです。実際のところ「本当の安全性ついては、まだわからないことの方が多い」、というのが現状なのですが、最後にちょっとだけ触れておきましょう。
まず表Iの無機顔料ですが、この表をザッと眺めただけでも、ずいぶん体に悪そうなものが多いことに気づくと思います。重金属はたいてい体にあまりよくはないのですが、その中でも、鉛、カドミウム、6価クロム、水銀と、正に錚々たる(?)顔ぶれが並んでいます。そして何故だかわかりませんが、これらの危ない金属を含む顔料はみんな鮮やかな、非常に綺麗な色をしています。同じ赤でも、安全性が高いと思われる鉄の化合物(弁柄)よりも鉛丹や辰砂の方が鮮やかですし、同じ黄色でも、ゲーサイトよりもカドミウムイエローやクロムイエローの方が鮮やかなのです。やはり「綺麗なものには毒がある」のでしょうか?
一方、有機の色素はどうかというと、こちらは、色も鮮やかで安全性も高いと(今のところ)言われているものがたくさんありますが、中には毒性があるものも知られています。例えば、図6の上段中央の青色はジーンズ生地の染色で有名なインディゴですが、これにも毒性があります(化学的にちょっと修飾すると食用色素にもなるからややこしい)。また右側中央の緑はマラカイトグリーンですが、この名前は聞いたことがある人もいるでしょう。元々殺菌作用があり、魚の病気の治療にも使われる有名な染料ですが、人体にとっても害がある可能性が高いということで、食用の養殖魚に使うことは禁止されています。ところが、このマラカイトグリーンが某国の養殖ウナギから検出されたということで、一時騒ぎになりました。便利な道具も使い方一つ、というのは、どこの世界でも同じですね。
雑科学ホーム
hr-inoueホーム







