
雑科学ホーム
hr-inoueホーム
● 界面活性剤の話 ●
境目の性質を変える ― 界面活性 ―
宇宙空間の話は別にして、世の中に無限の大きさを持った物などありません。どんな物にも「端」はあります。そしてその「端」というのは別の物との境界、つまり「界面」でもあるわけです。空気中や真空中では[表面」という言い方もしますが、これらも「空気」や「真空」との界面であることに変わりはありません。この「界面」の性質を変えるのが「界面活性剤」ということになります。その意味では固体でも液体でも気体でも界面や界面活性を考えることはできるわけですが、実用上は液体と液体の界面、あるいは液体と空気の界面、つまり液体の表面が問題になることがほとんどですから、これからの話は主に液体の界面、表面に絞ることにしましょう。
液体の分子はお互いに非常に仲がよく、互いに引き合って集まろうとする性質がありますから、多くの仲間の分子に囲まれているほど安定になります(もし仲が悪かったら一緒に集まったりはしませんから、液体という凝集状態にはならないはずです)。液体の奥深く(「表面」に対して「バルク」と言います)では周囲をぐるりと他の分子に囲まれていますから、非常に安定な状態になっているのです。これに対して界面では片側は仲の悪い他の液体(仲がよければ混ざってしまいます)や空気ですから、片側からのみ強く引っ張られて、エネルギーが高い不安定な状態になっていると言えます。
このようなエネルギーの高い状態をできるだけ解消するために、液体は表面積を減らそうとします。このことは日常のいろいろな現象で見ることができます。液滴が丸くなるのは球が最も表面積が小さい形だからです。液面に立てたガラス管の中を液が昇るのは、表面の凹レンズ状の窪み(液体がガラス壁を濡らすことによってできたものです)を平らに近づけて表面積を減らそうとするためです。一円玉やアメンボが水面に浮かぶのも、水面にできた窪みを平らに戻そうとする力が働いて、上に乗ったものを押し上げるからです。これらはいずれも、界面のエネルギーがバルクよりも大きいことによって起こる現象なのです(これらの現象を引き起こす力を表面張力と呼びますが、本当は界面のエネルギーがバルクよりも大きいことが根本原因であるわけで、力が働いていると考えた方が直感的に理解しやすいので「表面張力」という力を仮想的に考えただけです)。
このような液体に別の物質を溶かしてみましょう。この時、溶かした物質が液のバルクにも界面にも同じように散らばったのでは、バルクと界面のエネルギーの差は変わりませんから、いわゆる表面張力に変化は起こりません。しかし、何らかの原因でより多くの物質が界面に集まったら、その界面のエネルギーは小さくなる、つまり表面張力が減少します。このような性質が界面活性(表面活性)であり、特に大きな界面活性を持つ物質が界面活性剤(表面活性剤)です。このような作用が起こると、先ほど例に出したような表面張力に起因するいろいろな現象は現れにくくなります。液はガラス管の中をあまり昇らなくなりますし、一円玉やアメンボは沈んでしまうのです。
「界面に吸着する」ということ
ある物質が界面活性剤になるためには、バルクよりも界面に多く集まらなければなりません。これを「界面に吸着する」と言うことがあります。普通「吸着」と言えば、固体の表面にくっ付くような現象を指しますから、少々違和感があるかもしれません。しかし、
吸着の話でも書いたように、「吸着」というのはバルクと界面とで濃度が異なることを言うのですから、この表現でいいのです。このことをもう少し一般的な現象として見てみましょう。
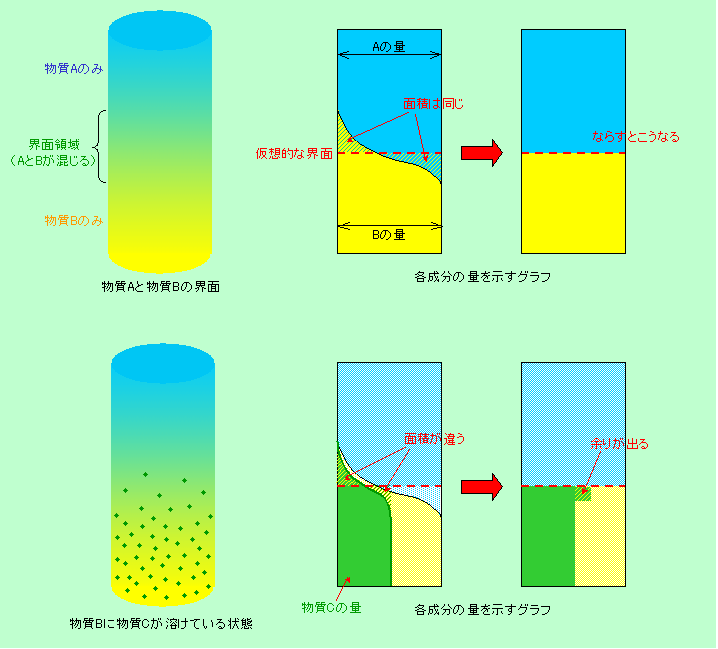
図1 界面への吸着の意味
図1は、物質Aと物質Bの界面への別の物質の吸着現象を表しています。上段の図はAとBに何も溶けていない場合で、AとBが全く混じり合わない物質であるならば界面はくっきりした一枚の面で表されますが、少しでも混ざり合う場合には、図のようにA100%からB100%まで、界面領域で徐々に組成が変化します。物質の量を横軸にとってグラフにすると、上段中央の図のように滑らかにA100%からB100%に移って行くのです。ここで、もしもAとBが全く混じり合わずに、Aが100%の状態からBが100%の状態に突然変化すると考えると、その界面はどこに来るでしょうか。それを示すのが図の赤の破線です。この線よりも下に入り込んだ物質Aの量と、この線よりも上に入り込んだ物質Bの量(斜線の部分の面積)が全く同じになるように、赤破線の位置を決めてやればよいのです。言うなれば「仮想的な界面」というところでしょう。2つの斜線部の面積は同じですから、平らにならせば右端の図のようになることはわかりますね。
次に、物質Bに別の物質Cが溶け込んでいる場合を考えます(物質Cは物質Aには溶けないとします)。下の方では物質Cの量は一定ですが、界面領域では物質Bが減って来るのに伴って次第に量が減って来て、物質Aが100%の領域では物質Cも無くなります。この時の物質Cの減り方は、必ずしも物質Bの減り方と同じ形にはなりません。例えば図1の場合ですと物質Cの減り方は緩やかで、物質Bに対する濃度という見方をすると、界面領域ではむしろ増えているのです。その結果、仮想的界面(赤破線)を挟んだ斜線部の面積は同じにはならず、平らにならすと右の図のように余りが出ることになります。つまり界面領域にある物質Cの量(物質Bに対する濃度)は、バルクよりも多いということであり、これが界面に吸着された状態なのです。
もし物質Aと物質Bが全く混じり合わないとすると、界面の状態は初めから右端の図のようになります。これが最も単純な界面吸着のモデルで、物質Cの濃度が界面で高くなっていることは一目瞭然ですね。
ただし、いつでも物質Cの濃度が界面領域で高くなるとは限りません。バルクと同じであったり、逆にバルクよりも低くなる場合もあります。界面領域での物質Cの濃度がバルクよりも低いということは、言い換えれば物質Bの濃度がバルクよりも高い、ということであり、界面に吸着しているのは溶質である物質Cではなく、溶媒である物質Bである、ということになります。これを物質Cの側から見れば、マイナスの吸着、つまり「負吸着」していることになるわけです(
吸着の話
参照)。
界面に吸着した物質が「界面活性」を引き起こす
液体に溶け込んだ物質が界面に吸着するとどうなるかを考えてみましょう。先ほど書きましたように、界面にある溶媒分子は仲のよい仲間の分子と片側でしか接していませんから、バルクにある溶媒分子よりもエネルギーが高く不安定な状態にあります。ところが、界面に別の溶質分子がたくさんあると、このような不幸な溶媒分子の数がその分だけ減りますから、全体の界面のエネルギーは減少します。つまり、この溶質分子は界面活性を示すのです。
溶媒分子の代わりに溶質分子が界面に出て来るのだから、溶質分子のエネルギーが高くなって、結局は同じではないか、と思われるかもしれません。確かにその通りで、溶質分子の場合でも界面ではバルクよりもエネルギーが高いのは事実です。しかし、溶媒分子に比べて、そのエネルギーの高まる程度はたいしたことはないのです。なぜなら、もしも界面に出てくることでエネルギーが高くなるような物質であるならば、わざわざ無理をして界面に出て来るはずはないからです。このような物質はバルクに留まっていた方が安定なのですから、界面には吸着しない、つまり負吸着することになるのです。
具体的な例を見てみましょう。図2には、水に別の物質を溶かした時の表面張力の変化を模式的に示しています。(a)は食塩などのいわゆる無機塩を溶かした場合で、濃度が高くなるほど表面張力は増加する「界面不活性」の形になっています。無機塩は水中で解離してイオンとなって溶けていますが、このイオンは周囲を水分子に取り囲まれることで安定度が大きく増加します。イオンが表面に出てくると逆に非常に不安定になりますから、無機塩のイオンは表面には吸着しません(負吸着します)。その結果、表面が純粋な水に近い状態であるのに対してバルクはイオンが溶けて安定化していますから、表面とバルクのエネルギー差はかえって大きくなり、表面張力が増加してしまうのです。
これに対して(b)は、アルコールなどの有機物を溶かした時によく見られる形です。アルコールなどは水の表面に多く集まる(界面に吸着する)性質がありますので、濃度が高くなるほど表面張力が低下する「界面活性」を示すのです。
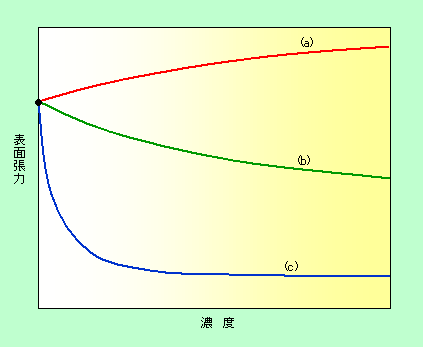
図2 水に別の物質を溶かすことによる表面張力の変化
図2にはこの他に奇妙な曲線が一本描かれています(c)。濃度と共に表面張力が低下する「界面活性」の形ですが、濃度が非常に低い領域でも劇的な効果がある一方で、濃度が高くなり過ぎると変化が小さくなっています。実はこれが本稿の主題である「界面活性剤」の典型的なパターンなのです。
界面活性剤の特徴的な形
図2(c)のパターンを示す界面活性剤には特徴的な分子構造があります。たぶんご存知でしょうが、それは、一つの分子の中に水に対する親和性が高い親水基と、水に対する親和性が低く油に対しての親和性が高い疎水基(親油基)を持っていることです。よく親水基は「○」で、疎水基は「―――」で表され、これらがくっ付いたオタマジャクシ型で界面活性剤を表現する方法が採られます。
親水基としては、イオンになっているものや酸素原子を多く含んだ構造になっているものがあります。一方疎水基は、普通は長い炭化水素の鎖です。図3に代表的な界面活性剤の分子構造を挙げておきました。
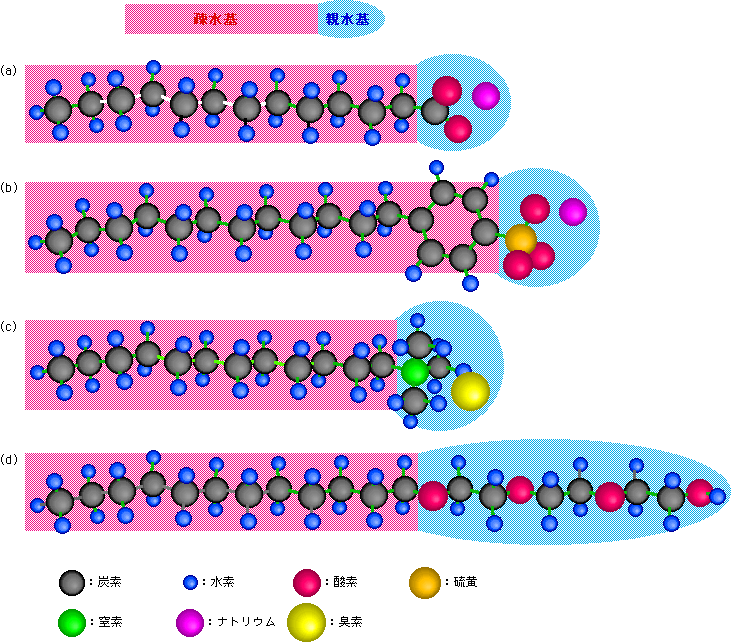
図3 代表的な界面活性剤
図3(a)はいわゆる石鹸です。油脂(動物の油など)を水酸化ナトリウムなどと混ぜて加熱することにより、油脂の中の脂肪酸と呼ばれる部分が分離して、ナトリウムなどと塩を作ったもので、親水基は陰イオンとなったカルボン酸、疎水基は炭化水素鎖です。この形の分子はイオンになる性質があまり強くありませんから、液のアルカリ性が少し弱くなると元のカルボン酸に戻ってしまい、水に溶けなくなって界面活性を失います。
図3(b)は代表的な合成洗剤であるアルキルベンゼンスルホン酸ナトリウムです。親水基はスルホン酸で、疎水基は炭化水素鎖とベンゼン環とからなっています。ベンゼン環に付いたスルホン酸は解離しやすく、少々のことでは界面活性を失いません。そのため石鹸と比べて洗剤としての能力は高いのですが、川や海に流れ出た時も強い界面活性を維持していますから、環境汚染が問題になっています。
これら2つは親水基が陰イオンですが、逆に陽イオンのものもあります(逆性石鹸などと呼ばれることもあります)。その代表例が図3(c)のアンモニウム塩型の界面活性剤です。また図3(d)のようにイオンを持たない非イオン性のものや、陰イオンになれる部分と陽イオンになれる部分の両方を持った両性界面活性剤もあります。
これらの界面活性剤は、親水基と疎水基の大きさや形によって性質が変わります。特に大きさは重要で、当然ながら大きければその部分の性質が強く現れることになります。この程度を表す指標として「親水性-疎水性バランス(Hydrophile-Lipophile Balance = HLB)」というものがあります。元々は界面活性剤の親水、疎水の性質を実験的に調べて決めた値なのですが、その後、親水基と疎水基の大きさ(分子量)の比率をもとに計算するようになりました。以前は、親水基と疎水基の分子量の比の対数をとり、これに適当な係数をかけたものに7を足して求める方法がよく使われました。例えば親水基と疎水基が同じ大きさの時はHLB値は7になり、7より小さい場合は疎水性、大きい場合は親水性が強いということになります。酸性度を示すpHとよく似ていますね。ただし最近は、単純に分子全体に対する親水基の比率を20倍したものが使われることが多いようです。こちらの方法ですと、親水基と疎水基が同じ分子量ならばHLBは10で、全部が親水性ならば20、全部が疎水性ならば0、親水基が35%を占める場合に7となります。
界面活性剤の溶け方
図3のような構造をした界面活性剤を水に溶かしてみます。すると、親水基は水によくなじみますが疎水基は水との相性が悪いですから、疎水基を空気中に突き出した形で水面に出て来ます。アルコールなどの普通の有機物と比べて、表面への吸着が圧倒的に多いのです。これが低濃度でも大きな界面活性を示す原因です(図4左)。
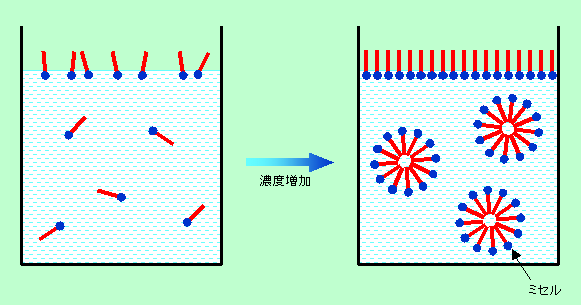
図4 界面活性剤の水への溶解
ところが、濃度が高くなり過ぎると事情が違って来ます。水中で界面活性剤どうしが疎水基を内側に、親水基を外側に向けて集まり、外から見ると全面が親水性の塊(ミセル)となってしまうのです(図4右)。こうなると、もう界面活性はありませんから、図3(c)のように、いくら濃度を高くしても表面張力は変化しなくなるのです。
溶媒が水ではなくて油系のものである場合には、今度は親水基を液面から突き出し、図4とは逆さまに並びます。濃度が高い場合にできるミセルも、親水基を内側にした形になり、「逆ミセル」と呼ばれます。
ところで、界面活性剤の中でも特に疎水性の強いものでは、適当な有機溶媒に溶かして水面に落とすと、分子一個の厚さの膜を作る場合があります。この膜は非常に面白い性質を持っていますので、後で詳しく説明することにします。
界面活性剤のはたらき
界面活性剤の重要なはたらきの一つは、界面のエネルギーを下げる(表面張力を下げる)という定義そのものから来る作用です。この作用によって、濡れ、浸み込みをよくし、洗浄などの効果を高めるのです。もう一つの大きなはたらきは、性質の異なる物どうしをなじませる、というものです。水と油のような液体どうしを混ぜて乳化させたり、固体の粉末を液体中に分散させたりする用途に使われます。また逆に、2つの物のなじみを悪くすることも可能で、固体どうしの摩擦を減らして潤滑効果を出すのに有効です。これらのはたらきについて順に見て行きましょう。
濡れ、浸み込みをよくする
液体は界面のエネルギー(表面張力)のために丸くなろうとします。これは固体の上に液滴を乗っけた場合も同じで、固体と液体との相性が悪い場合には、その接触面積を減らすために丸くなります。ガラスの食器を考えましょう。食器がものすごくキレイに洗われている場合には、水をかけるとスッと広がって、食器全面を均一に濡らします。しかし食器が油などで汚れていると、水はサトイモの葉に付いた露のように丸くなってしまいます。汚れを落とすためには、その汚れを水の中に溶かし出す必要がありますが、その前に、まず水と汚れをちゃんと接触させなければなりません。そこで界面活性剤(洗剤)の登場です。界面活性剤を水に加えることで油との間の界面のエネルギーを下げ、食器の表面を水で濡らすのです。この後、界面活性剤が汚れを包んで水中に溶かし出すのですが、この部分は後で説明します。
固体の表面を濡らす、という意味では、布などへの浸み込みも重要です。布は繊維を織って作られていますから、繊維間の隙間がたくさんあります。この隙間を細い管に見立てましょう。もし液体と固体の相性が十分よいのならば、図5(a)のように液体は放っておいても管の中に勝手に入って行きます(毛細管現象)。ところが液体と固体の相性が悪いと、逆に液面が引っ込んでしまいます(図5(b))。多くの繊維は水との相性がよくありませんから、大抵は図5(b)のようになってしまうのです。雨に濡れた場合などは水をはじいてくれた方が好都合ですが、洗濯をする場合には、繊維間の隙間まで水を行き渡らせなければなりませんから、図5(b)のような状態では困るわけです。界面活性剤は図5(b)の状態を図5(a)の状態に持って行き、繊維の隅々にまで水を浸み込ませるはたらきをするのです。
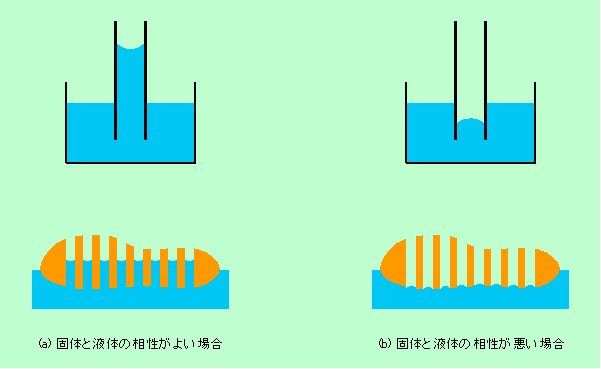
図5 細い管(繊維の隙間のモデル)への液体の侵入
相性の悪いものをなじませる
界面活性剤のもう一つの重要なはたらきは、元々性質が異なり相性が悪い物どうしをなじませることです。この作用は、親水基と疎水基を持つという界面活性剤の構造に起因するもので、表面のエネルギーを低下させるという作用とは少し違っています。
基本になるのは図4に出て来たミセル(または親水基、疎水基の向きが反対になった逆ミセル)です。例えば普通のミセルでは、外側は親水基で覆われていますから、水にきれいに分散します。一方でミセルの内部は疎水基ですから、疎水性の物質を取り込むことができます。その結果、本来は水中には分散しない疎水性の物質を、ミセルで包むことで水の中に安定に分散させることができるのです。反対に親水性の物質を逆ミセルの中に包んで油の中に分散させることもできます。
対象になる物質が両方とも液体である場合、このような作用を「乳化」、できたものを「エマルション」とよんでいます。身近な例としては、牛乳が挙げられるでしょう。牛乳は水の中に脂肪の粒が文字通り乳化したもので、粒の回りは天然の界面活性剤(タンパク質)で囲まれています。マヨネーズも同様に、水の中に油が分散したもので、これらを「水中油滴型エマルション」と呼びます。逆に油の中に水を分散させたのが「油中水滴型エマルション」で、こちらの例としてはバターやマーガリン、グリースなどが挙げられます。ただし一部のマーガリンには、サッパリ感を出すために水中油滴型になっているものもあります。
「水中油滴型」になるか「油中水滴型」になるかは、水と油のどちらが多いかではなくて、主に界面活性剤(乳化の場合は特に「乳化剤」と呼ぶことが多いです)の性質で決まります。親水性が高い界面活性剤を使うと「水中油滴型」に、疎水性が強い界面活性剤を使うと「油中水滴型」になるのです。ですから、油が80%を占めるのにエマルションの型は「水中油滴型」ということもあり得ます。先に出て来たHLBというのは、元々はこのエマルションの型を実験的に調べて決められたものだったのです。
分散しているものが固体の場合は、そのまま「分散」と呼びます。金属酸化物などの無機物の粒子は親水性の表面を持っていますから、本来は油系の溶媒には分散しにくいのですが、界面活性剤を使えば分散が可能になります。また疎水性の有機顔料などは逆に界面活性剤によって水系の溶媒に分散させることができます。このあたりの詳細は
微粒子分散系の話に詳しく書いていますので、そちらをご覧下さい。
洗剤で汚れを落とす場合にも、この乳化、分散のはたらきが関係しています。前の項で洗剤のはたらきの一つは洗う対象を濡らすこと、と書きましたが、濡らしただけではもちろん洗浄したことにはなりません。水洗いで落ちない汚れの大部分は脂質やたんぱく質などの疎水性の汚れですから、界面活性剤のミセルでこれらの汚れを包み込んで水中に分散させることが必要なのです。一旦ミセルになってしまえば表面は親水性ですから、汚れが再び衣類などに付着するのを防ぐことができます。その意味で、最低でもミセルができる程度の量の洗剤が溶けていなければ洗浄効果は期待できない、ということになります。
また、乳化というのは液体の中に全く性質の違う小部屋を作ることですから、その小部屋の中だけで化学反応を起こさせて微粒子を合成する、といったことにも使われています。回りが保護されているので、できた微粒子がすぐに凝集したりしませんし、大きさが揃いやすく、形もまん丸になりやすいなど、色々な利点があるのです。
その他の活躍いろいろ
親水性のものと疎水性のものをなじませるのが界面活性剤の代表的な使い方なわけですが、親水性のものどうしのなじみを悪くして潤滑性を持たせる、という使い方もあります。例えば金属製のギアや車軸などでは、親水性である金属どうしが焼き付いて離れなくなってしまうことがあります。このような場所に界面活性剤を塗ると表面を覆って疎水化し、焼き付きを防いでくれます(ついでに水をはじいてくれることで錆の防止にもなります)。この場合、界面活性剤の疎水基どうしが向き合うことになりますが、疎水基どうしの相互作用は小さいので焼き付きは起こりません(疎水基どうしの相互作用をもっと小さくするために、水素をフッ素で置き換えたタイプの界面活性剤もあります)。また、界面活性剤を添加して金属表面を疎水性にしておくことで、潤滑油が間にすんなりと入り込んで働きが良くなる、ということもあります。
泡を作るのも界面活性剤のはたらきの一つです。表面張力の大きい液体で薄い膜を作ろうとしても、液体の分子が引っ張り合って集まろうとしますから、すぐに割れてしまいます。しかし界面活性剤で表面張力を下げると、空気を吹き込んで薄い膜にしても壊れず、泡として安定に存在できるのです。洗剤の泡、いわゆるシャボン玉もこうしてできています。ただし、泡そのものは洗浄効果とはあまり関係がありません。実際に洗濯機の中で泡は水面に浮いてしまっていますから、肝心の衣類には接触していないのです。もっともボディーソープやシャンプーなどでは、泡立つことで滑らか感を出して洗いやすくする、という効果はあります。
泡の使い道でちょっと変わった例として、鉱石の浮遊選鉱というのがあります。鉱山で採掘された鉱石には不要なものもたくさん混じっています。そこで、一度粉々に砕いた後に適当な界面活性剤で処理して水に分散させ、ここに泡を吹き込みます。有用な鉱石と不要な石とは表面の状態が違っていますから、うまく処理してやれば、有用な鉱石の表面だけを界面活性剤で疎水性にすることができ、疎水性になった鉱石の粉が泡にくっ付いて浮かび上がって来るのです。
この他に、疎水性の繊維に付着して表面を親水性にすることで、空気中の水分を引き付けて静電気を防止することにも使われています。またある種の陽イオン型界面活性剤では、微生物に付着させて(微生物の表面はマイナスに帯電していることが多いので、陽イオン型界面活性剤が吸着しやすいのです)殺菌するのに用いられたりもします。
ちょっと余談になりますが、シャボン玉以外にも界面活性の効果を利用した遊びがあります。アメンボを沈めるというような悪いイタズラは別にして、「ショウノウ(樟脳)ボート」などがその代表でしょう。樟脳というのはクスノキから抽出される固形成分で、昔は防虫剤に使われていました。これを木などで作ったボートの後尾に取り付け、水面に樟脳が触れるようにして水に浮かべると、ボートが走り出すのです。樟脳は界面活性剤の類ではありませんが、水にわずかに溶けて表面張力を下げる働きがあるので、ボートの前方の水と、後方の樟脳が溶けた水との表面張力の差によって、より高い表面張力を持った前方の水の側に引っ張られるのです(ボートの前側に比べてエネルギーが小さい後側の水面が広がろうとする、と言うこともできます)。もっとも最近の防虫剤はパラジクロルベンゼンかピレスロイドですから、樟脳はなかなか手に入りません。そこで、代わりにアルコールボートを紹介しておきましょう。
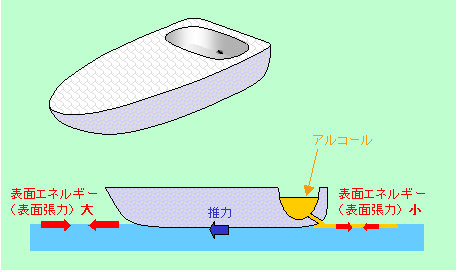
図6 アルコールボート
発泡スチロールで図6のようなボート型を作り、後部に作った窪みの部分から船尾に向けて針で孔をあけます。これを水面に浮かべて窪みにアルコールを入れれば、針孔から徐々に漏れ出たアルコールが後方の水の表面張力を下げて、樟脳ボートと同様にボートが前進します。純粋なアルコールでなくても、ウイスキーなどの度の強いお酒でも十分に走ります。
界面活性剤が作る超薄膜 ― ラングミュア-ブロジェット膜 ―
疎水性が強く水に溶けない界面活性剤の中には、適当な有機溶媒に溶かして水面に落とした時に分子一個分の厚さで水面に広がるものがあります(水に溶けないものは普通は界面活性剤とは呼びませんが、疎水基と親水基を持った構造をした仲間ということで、まとめてこう呼ばせてもらいます)。これは水面に油が浮いて膜を作るのとはわけが違います。普通の油膜では光の加減で変化する虹色が見えますね(シャボン玉も同じ)。これは光の干渉によるものですが、光が干渉するためには、光の波長と同じ程度の膜の厚さが必要です。つまり水面の油膜は0.1〜1μm(100〜1000nm)くらいの厚さがあります。これに対して、これから話題にしようとしている単分子膜は普通0.01μm(10nm)もないのです。図4の水面にできているのがまさにその形で、親水基を水中に、疎水基を空気中に突き出して水面に「立って」いるのです。
水面上に広がった単分子膜の部分は表面張力が下がりますから、膜の部分と裸の水面との境界線は、裸の水の側に引っ張られます。言い換えれば、単分子膜の部分は表面エネルギーが小さく、そのエネルギーが小さい領域を拡大するために外に向かって広がろうとするわけで、一種の圧力を持っていると考えることができます。真空にした容器の中に気体を入れると、その圧力ですぐに容器いっぱいに広がるのと同じですね。ただ、立体(3次元)と平面(2次元)の違いがあるだけです。この広がろうとする力を表面圧と呼びます。表面圧は水面上に何らかの仕切りを作ってその仕切りにかかる力を計れば知ることができます。
ここで、その仕切りを界面活性剤の側に少しずつ押し込んで見ましょう。3次元で言えば、気体が入った注射器のピストンを押し込むようなものです。すると単分子膜は次第に圧縮されて、表面圧が上がって来ます。まさに気体を圧縮している感覚です。この時の単分子膜の面積と表面圧の関係をグラフにすると図7のようになります。これは気体を圧縮して液化する場合とそっくりですね。
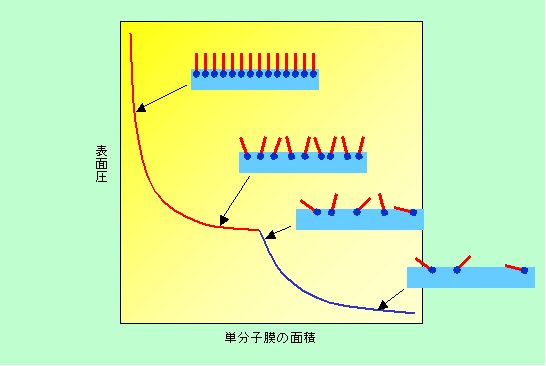
図7 水面の界面活性剤膜を圧縮すると・・・・・
初めのうちは界面活性剤の分子はまばらですから、ちょっとの力で面積を押し縮めることができます。つまり表面圧は小さいわけです。それでも面積が小さくなると、表面圧は徐々にですが上がって行きます。これは体積を小さくすることで圧力が徐々に上がる気体に類似した状態、と言うことができます。単分子膜の面積がある一定の値に達すると、それまでは個々に独立していた界面活性剤分子が互いに引き合って集まるようになります。分子が自分たちで勝手に集まって行くのですから、外から余分な力を加える必要はありません。その結果、表面圧はあまり変化しないで面積だけが急激に小さくなります。ちょうど気体分子が集まって液体になるのと同じ状態で、一種の2次元の相変化です。界面活性剤分子が完全な集合状態、いわば2次元の液体の状態になると、突然ガクンと硬くなります。ここからはちょっと面積を小さくするにも大きな力が必要になります。3次元の液体の場合に、少々圧力をかけても体積が変わらないのと同じことです。ここからさらに圧力を上げて行くと、分子が完全に配列した固体に相当する状態に変化する点が現れる場合もあります。
このように、水面に広がった界面活性剤の単分子膜は、2次元の気体-液体-固体という相変化を見せるのですが、条件によっては相変化が見られない場合もあります。例えば温度が低い場合や分子が長い場合は、初めから(表面圧の低い状態から)凝集状態になることがありますし、逆に温度が高い場合や分子が短い場合には分子が活発に動き回りながら圧縮されるので、ちょうど
超臨界流体のように、はっきりした相変化を示さないで、なだらかに表面圧が変化するケースもあるのです。
界面活性剤の膜で面白いのは、やはり液体、あるいは固体に相当する部分でしょう。この領域では、分子は自分自身で、それこそ分子レベルで整列しているわけで、今流行りの「自己組織化」の一種です。ただし、水面に浮いている状態では使い勝手が悪いですから、これを適当な基板の上に移し取る必要があります。それには、図8に示したようにいくつかの方法があります。
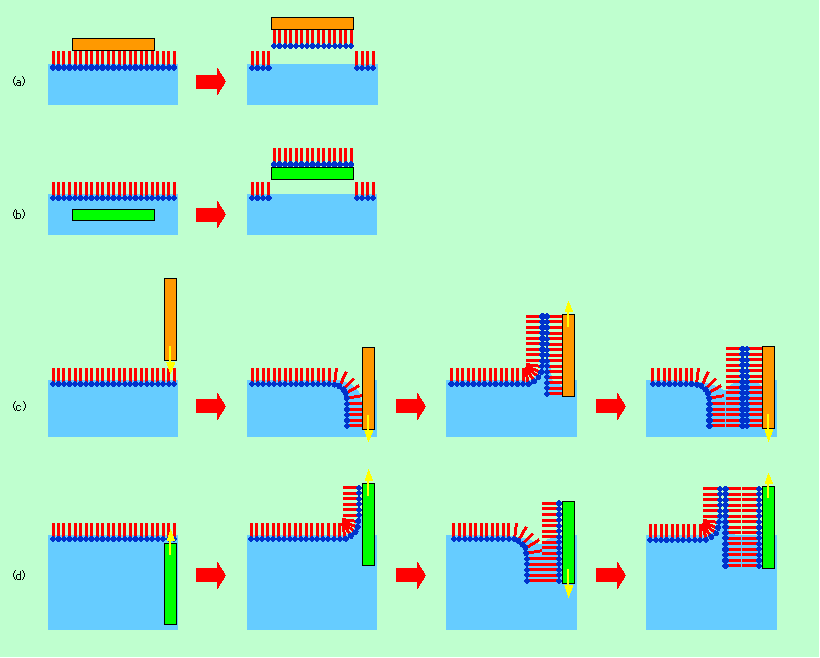
図8 水面の単分子膜を基板に移し取る方法
一番単純なのは、図8(a)のように上から基板をかぶせてくっ付けてしまう方法です。このやり方では、界面活性剤の疎水基と基板表面との相性がよくないとうまく付いてくれません。一方、図8(b)のように初めから基板を沈めておき、これを持ち上げるか水を抜くかして単分子膜を付着させる方法では、親水性の基板の方がよいわけですが、界面活性剤の親水基と基板とのなじみが多少悪くても、強引に基板に膜を載せることはできるようです。
最も有名なのは、図8(c),(d)のように基板を垂直に出し入れする方法でしょう。基板表面が疎水性の場合には(c)のように上から差し入れる方向に、親水性の場合には(d)のように水中から引き上げる方向に動かすのがよいことはすぐに理解できると思います。この操作を何回も繰り返すと、積層膜を作ることもできます。例えば(c)の例では、初めに上から基板を差し入れることで疎水基側が基板に付き、親水基側が外を向いた膜が基板上にできます。これを今度は水中から引き上げると、初めに付着した膜の親水基に水面の膜の親水基がくっ付いて、向きが逆の2層目ができます。さらに出し入れを繰り返せば、図のように向きが交互になった多層膜が作れることになります。
このような基板上に移し取った膜のことを、発見者の名をとってラングミュア-ブロジェット膜(Langmuir-Blodgett膜)、略してLB膜と呼びます。これに対して水面上の単分子膜のことをラングミュア膜(L膜)と呼ぶ場合があります。
LB膜を作る方法は先に書いた通りですが、実際には水面上の膜を基板に移し取ると、その分だけ水面の界面活性剤が減りますから、膜の状態が崩れて来ます。これを防ぐためには、基板への移し取りを進めながら水面上の膜を圧縮して行く必要があります。このような操作を自動化し、基板の動きと連動して仕切りが移動するようになった装置が市販されています。
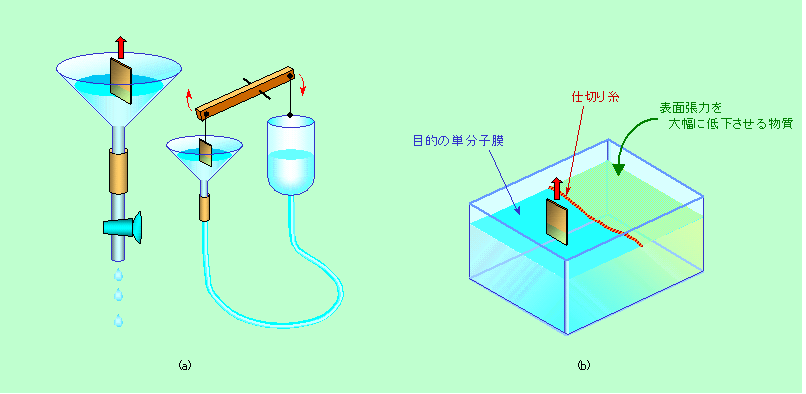
図9 LB膜を作る簡単な工夫
自動化した装置はそれなりに高価ですが、とりあえずLB膜作りを試してみるだけならば、仕切りを手で動かしても何とかできないことはありません。あるいは図9(a)のように漏斗を使った方法でもできます。下のコックを開いて水を捨てることで徐々に水面を下げ、面積を小さくして行くわけです。液をただ捨てるのではなくて、漏斗の先につないだ液溜めを上下させることで液面の高さを調節できるようにすれば、もっと細かい制御が可能です。液溜めの動きと基板の動きを滑車などを使ってうまく連動させてやれば、立派なLB膜作製装置ができますよ。
また、かつてBlodgettがやったように、水面を糸などで仕切り、一方の水面に膜を作る物質、もう一方にそれ以上に表面張力を下げる効果の大きい界面活性剤を落とす、という方法も可能です(図9(b))。この場合、表面張力がより小さい右側の水面が仕切りの糸を左側に押し込みますから、左側の界面活性剤膜は圧縮された状態になります。そのため基板に移し取ることで界面活性剤が減っても、右側の水面が糸を押して、常に一定の圧縮状態を保てるのです。
LB膜は作り方がデリケートですから、あまり大量生産向きとは言えません。それでも、何せ分子レベルで状態が制御できるのですから、材料としての魅力はあります。電子や光を制御する分子素子やセンサーだとか、生物の体内ではたらく生体膜のモデルだとか、様々な分野で研究が続けられています。あるいは、LB膜そのものを利用するのではなく、目的とする別の原子や分子を一つの平面に一層だけきれいに並べるための型としてLB膜を使うこともできます。もっと手軽に、少々乱暴なやり方でも作れるようになれば、工業化の可能性も広がるかもしれません。
雑科学ホーム
hr-inoueホーム









