
雑科学ホーム
hr-inoueホーム
● ガラスの話 ●
液体のような固体?
物質を構成している原子・分子の位置や向きが規則的にビシッと決まっていて流動性がないのが
結晶、この中から位置の制限が緩くなって移動が許されるようになり、流動性が出て来たのが
液晶であることは、別の項でも書きました。これに対して、原子や分子が自由に移動することはできず流動性がないのに、その位置や向きが「ビシッ」とは決まっていない固体があります。これが「非晶質(アモルファス)」で、その中で、ゴムのように柔軟ではなく硬いものを「ガラス」と呼んでいます。おなじみの窓ガラスやガラスコップだけでなく、プラスティックの類も温度によって結晶になったりガラス状になったりしますし、金属の中にも原子の配置が乱れたガラス状のもの(アモルファス金属)があるのです。とは言うものの、アモルファス全体まで範囲を広げると書くことが多くなり過ぎてパンクしそうですから、ここでは狭い意味の、ケイ素と酸素を主成分とするいわゆる「ガラス」を主に取り上げることにします。要するに、窓ガラスやガラスコップ、ビー玉などの類です。
普通の固体(結晶)は温度を上げて行くと、ある特定の温度(融点)で原子・分子の配置が乱れて液体になります。しかし、ガラスは元々原子・分子の配置が乱れているのですから、特定の温度で急に変化するのではなく、徐々に流れて液体状になって行きます。そのため、「ここまでは固体でここからが液体」という境目がなく、固体と液体の区別がはっきりしません。唯一の区別ポイントは流動性、ということになるのですが、これがまた非常に曖昧なものです。例えばガラスコップを置いておいたら流れて皿になった、ということは普通は起こりませんが、ものすごく長い時間スケールで、それこそ何万年後とか何億年後とかを考えたら、ガラスコップもいくらか変形しているかもしれません(
粘弾性の話参照)。つまり、温度だけでなく時間のスケールによっても状況が変わって来るのです。このように考えると「ガラス」というのは、「液体状態のまま固まった固体」とも言えますし「流動性が極端に低い液体」という言い方もできることになります。
なぜガラス状態ができるのか
水が高いところから低いところへ流れるように、放っておけば物質は最も安定な、エネルギーの低い状態に落ち着きます。つまり
結晶状態です。それではなぜ、わざわざ不安定なはずのガラス状態になるのでしょうか。実は好んでガラスになっていると言うよりも、結晶になり損ねて仕方なくガラス状態に留まっている、というケースが多いのです。
液体を冷やせば固体になります。この時、原子や分子は最も安定な配列になろうとしますから、ここで結晶ができます。ところが、冷やすのがあまりにも速過ぎて、安定な位置まで移動する余裕がなかったらどうなるでしょうか。原子や分子はその場で凍り付いてしまいますね。これがガラスです。冷やすのが速いか遅いかという基準は物質の種類によって全く違い、結晶になりやすい物質では、それこそ瞬間的に冷やさなければガラス状態にはなりません。これに対して結晶にならなくてもそこそこ安定になれる物質では、かなりゆっくり冷やしても結晶化しないでガラス状態になってしまいます。この様子を模式的に示したのが図1です。
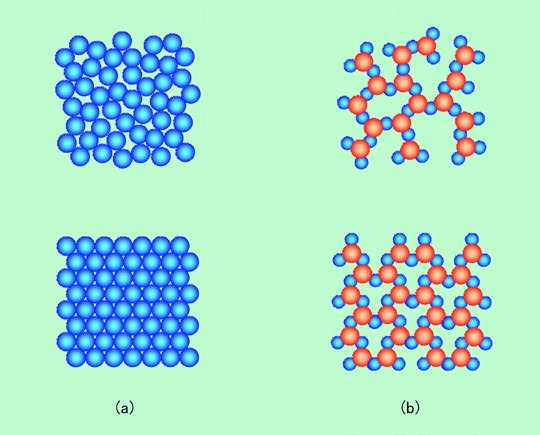
図1 ガラス状態と結晶状態
初めに図1(a)のような球形の粒子からできた物質を考えましょう。液体状態では上段のように粒子の位置はデタラメです。これを冷やすと粒子の動きが鈍くなって固体化するのですが、球形の粒子の場合は上段のような不規則な形のまま固まるガラス状態よりも、下段のような整然とした結晶状態になるケースが多くなります。コップにビー玉を詰め込んだ時のことを考えてみてください。玉が正三角形や正六角形を並べたような形にきちんと積み重なった構造が(途中に部分的に乱れた場所があるにしても)自然にできますね。一気にドサッと放り込むと上段のようなガラス状態ができることもありますが、この場合もちょっと揺すってやると、自然に下段のような構造ができて来ます。整然と並んだ方が座りが良くて安定なのです。これに対して図1(b)のような少し複雑な形をした分子の場合、下段の整然とした構造を作るのは必ずしも簡単ではありません。このような形の模型を作って容器に詰め込んでも、整然と並んだ構造が自然にできることはまずないでしょう。きれいに並んだ形に無理にならなくても、それほど不安定ではないのです。
現実の原子・分子では互いの間にいろいろな相互作用がはたらきますから模型のように単純には行きませんが、似たような状況は起こります。例えば、個々の粒子が球形と考えられる金属の場合、普通に固めればたいてい結晶状態になります。これをガラス状態にするには、数千度の温度で融かした状態から千分の1秒ぐらいの短時間に一気に冷やさなければなりません。(同じ金属でもいろいろな大きさの粒子が混ざった合金の中には、何十分もかけてゆっくり冷やしても結晶にならない特殊なものもあります。いろいろな大きさのビー玉を混ぜると、きれいな構造ができにくくなるのと同じですね。) 一方、今回の主題である酸素とケイ素からなる化合物、「二酸化ケイ素(シリカ)」の場合、基本となる構造は球ではなくて、ケイ素の周りに4個の酸素が配置した正四面体になります。ですから図1(b)のように(図では平面で表しているので正三角形ですが)、必ずしも結晶状態にならなくてもそれほど損はなく、ガラス状態で固まることが多くなるのです。
二酸化ケイ素の七変化
それでは、本題のガラスからは外れますが、二酸化ケイ素が作る結晶の様子を少し見ておきましょう。二酸化ケイ素の結晶は一種類だけではなく、様々な形があります。炭素の結晶にダイアモンドとグラファイトがあるのと同じようなものですが、それよりももっと種類が多いのです。そして温度と圧力によって、どのタイプの結晶が安定でいられるかが決まります。
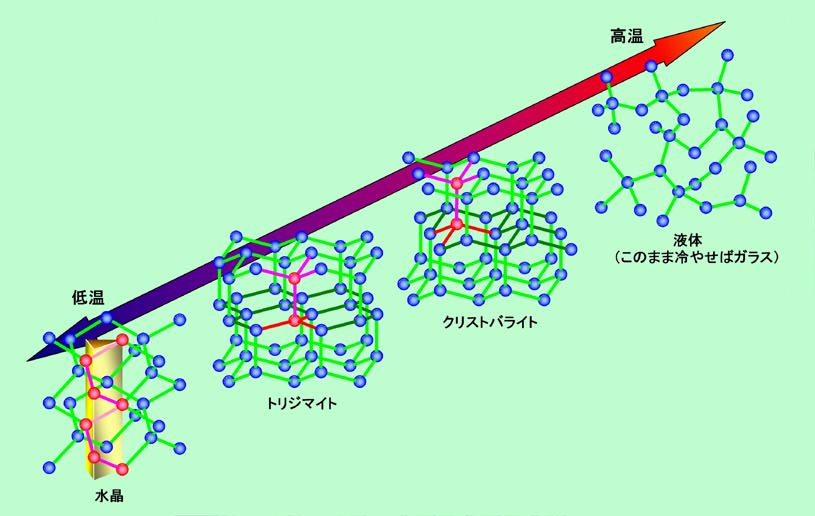
図2 二酸化ケイ素が作るいろいろな結晶とガラス
普通の圧力で、最も低温で安定なのが、例の六角柱の形で有名な水晶です。一応、結晶構造の図(酸素は省略してケイ素だけ)を描いてみましたが、複雑でよくわからないかもしれません。ポイントは図に赤で示した一連のケイ素で、このように三角柱に巻き付くように螺旋を描いているのです(赤で示した以外の原子も、よく見れば同じように螺旋を描いているのがわかります)。図の螺旋は進行方向に向かって左巻きですが、同じように右巻きの螺旋を持つ結晶もあり、それぞれ右水晶、左水晶と呼ばれています。アレッ?、と思いますよね。左巻きなのに右水晶? 実は「右水晶」「左水晶」という呼び名は、水晶に入って来た偏光が回転して行く「旋光性」という性質から付けられるのですが、その回転方向は、向こうからこちらに向かって来る光を見た時の方向で示すことになっているのです。ですから、左巻き螺旋の水晶の場合は螺旋の向きと同じ左回りに偏光が回転するのですが、出口側から見ればこれは右回転ですから、「右水晶」ということになるのです(旋光性については
液晶の話にも書いているので参照してください)。
温度が573℃を超えると、水晶の様子がちょっと変わって来ます。図では省略していますが、低温の場合、酸素はケイ素とケイ素を結ぶ線上から少し横にズレた位置にあります(「ケイ素」―「酸素」―「ケイ素」の角度は146.5°)。この方が原子が密に詰まるからです。ところが温度が高くなると、酸素は2個のケイ素の真ん中に近付き(「ケイ素」―「酸素」―「ケイ素」の角度は155°)、ケイ素自体も直線的に配列して、よりキッチリした形になります。これが高温型水晶です。大雑把には、温度が高くなると原子の動きが活発になるために、密に詰まった構造よりも、より広がった形を採りやすくなる、と言えるでしょう。実際に低温型水晶の密度は2.7g/cm
3ですが、高温型ではやや小さく、2.5g/cm
3になります。この高温型水晶はきれいな六角柱にはならず、ソロバン玉のような外形をしています。また低温型に見られる
圧電性もなくなってしまいます。
温度が900℃ぐらい(正確には867℃以上)の領域に入って来ると、全く違った構造が安定になります。トリジマイトと呼ばれるもので、図のようにケイ素が正四面体の中心と頂点に位置する形でつながっています。上から見るとケイ素が六角形を作っていますが、下の層にもその下の層にも同じ位置に六角形があり、上から下まで六角柱がズドーンと貫通した形になっています。このトリジマイトにも低温型と高温型があり、水晶の場合と同じように、高温型では「ケイ素」―「酸素」―「ケイ素」が一直線になるのに対して、低温型では少し折れ曲がった配置になります。
温度がさらに上がって1500℃ぐらい(正確には1470℃以上)になると、今度はクリストバライトという結晶が有利になります。これもトリジマイトと同様にケイ素が正四面体を作るようにつながっているのですが、その配列がちょっと違います。図の中に赤で示した上下に並んだ原子がありますね。トリジマイトではそれぞれの原子から出る枝の方向が上下でピッタリ一致するのに対して、クリストバライトではこれが60°ズレて互いの間に入るようになっているのです。そのため、上から見た時にケイ素が作る六角形が、クリストバライトでは上下でズレることになります。気付いた人も多いと思いますが、このクリストバライトの構造はダイアモンドと全く同じです。また、クリストバライトにもトリジマイトと同じように高温型と低温型があります。
温度が1713℃を超えて来ると、もう結晶状態ではいられません。ドロドロに融けた液体の状態になります。そして、ドロドロに融けた状態からそこそこの速さ(1時間に数十度ぐらいのペース)で冷やしてやれば、そのまま石英ガラス(シリカガラス)として固まります。このように二酸化ケイ素には、温度の低い方から順番に、低温型水晶―高温型水晶―低温型トリジマイト―高温型トリジマイト―低温型クリストバライト―高温型クリストバライト―液体、という7種類の形があるのです(圧力が高い場合にはまた別の形が現れますが、ここでは省略)。ただし注意が必要なのは、ある温度にしたからと言って、それぞれの結晶形がパッと現れるわけではない、ということです。同じ結晶の低温型と高温型の変化は(原子間の角度がちょっと変わるだけですから)簡単に起こりますが、水晶、トリジマイト、クリストバライト、石英ガラスの間の変換は容易ではありません。原子のつながりを組み替えなければならないからです。そのため、例えばクリストバライトを作ろうとすれば、溶融状態から1500〜1600℃ぐらいまで冷やしてその温度を何十時間も保ち続ける必要があります。逆に、一旦クリストバライトができてしまえば、それを冷やしても、トリジマイトに変わったり水晶に変わったりすることはほとんどありません。そんな訳で、普通の気温の中で水晶もトリジマイトもクリストバライトも、そして石英ガラスもちゃんと存在しています。もちろん、室温まで冷えて来ると内部構造はそれぞれの低温型に変化してしまうのですが、外形は(割れたりしなければ)高温下で結晶化した時のまま保たれます。例えばソロバン玉型の高温型水晶が冷えても、あの六角柱に形が変わることはなく、ソロバン玉のままで内部構造だけが低温型になるのです。
いろいろな成分を添加して作る様々なガラス
化学系の実験室などでは、熱に強く、余計な成分が溶け出したりしないということで、純粋な二酸化ケイ素からできた石英ガラス(シリカガラス)はよく使われます。坩堝(るつぼ)だとか、光学測定用の試料容器だとか、あるいは特殊なビーカーやフラスコなどです。しかし普通の実生活で石英ガラスにお目にかかることはめったにありません。高い温度にしなければ融けないので、融かして整形するのが難しく、また硬くて脆いので、後から切ったり削ったりして加工するのも容易ではないためです(もちろん加工が難しい分、高価になります)。そこで、溶融温度を下げたり、軟らかくしたり、粘りを出したりと、いろいろ都合のよい性質を持たせるために、二酸化ケイ素に様々な成分を加えたガラスが使われています。代表的な添加成分は、ナトリウム、カルシウム、鉛、アルミ、ホウ酸などです。これらの余分な成分が加わると二酸化ケイ素が結晶を作りにくくなりますから、よりガラス化しやすくなる、という特徴も出て来ます。
最も普通のガラスと言えば、ナトリウムを添加したソーダガラスでしょう。ナトリウムを十数%混ぜることで溶融温度を大幅に(1000℃ぐらいまで)下げることができるのです。ただし、これだけでは弱くなり過ぎるので、さらにカルシウムを加えて強度を高めるのが普通です。もちろん純粋な金属ナトリウムやカルシウムを入れるのではなくて、炭酸ナトリウム(ソーダ灰)や炭酸カルシウム(石灰)の形で二酸化ケイ素と一緒に融かして固めます。窓ガラスやガラスビンなどの大半は、このソーダガラス(ソーダ石灰ガラス)なのです。ソーダガラスには不純物として鉄が含まれることが多く、そのためにやや青緑に色が付きます。薄いガラスではあまり目立ちませんが、断面などを見るとたいてい緑がかった色が見えるはずです。
鉛もガラスの添加成分として有名です(酸化鉛として入っています)。ガラスの中に鉛を入れると、軟らかくなるだけでなく密度が上がり、屈折率を高くすることができるのです。この「屈折率」というのは、見た目の印象に極めて重要です。屈折率が高いと、表面での光の反射が強くなってツヤが出て来ます。また
全反射を起こしやすくなりますから、ガラスを加工して多面体状にカットしてやると、外から入って来た光が内部で全反射を繰り返していろいろな方向に出て行くことになり、キラキラと輝くようになるのです(
結晶の話参照)。これがクリスタルガラスです。重量感があり、ツヤがあってキラキラと輝き、しかも軟らかくて切削加工しやすいという、まさに装飾品にピッタリの性能を持っているわけです。とは言うものの、「鉛」と聞くとやはり毒性が気になるところです。ガラスの中に入り込んだ鉛はそう簡単に外に出て来ることはありませんが、別の金属で代用できるのであればそれに越したことはありません。そこで鉛に代わって亜鉛やバリウムを含むガラスが、新しいクリスタルガラスとして開発されています。また鉛ガラスには、クリスタルガラス以外にも、X線などを遮断する窓ガラスとして重要な用途があります。ブラウン管用のガラスやX線を使った分析装置などの窓材として不可欠ですが、これにも鉛の代わりにストロンチウムやバリウムを使った新しいタイプのものが出て来ています。
ソーダガラス、鉛ガラスと並ぶもうひとつの主要なガラスとして、ホウケイ酸ガラス、というのがあります。これは二酸化ケイ素にホウ酸を混ぜたもので(ナトリウムやアルミなども含まれています)、強度があり、薬品や温度変化にも強いので、化学実験用の器具類に広く使われています。「パイレックス(PYREX)」という商品名は、化学系の人にはおなじみでしょう。また、このホウケイ酸ガラスを望みの形に整形した後に、熱処理と酸処理でホウ酸分を取り除き、もう一度焼き固めたガラスもあります。このガラスは大部分がシリカですから、石英ガラスのように加工に苦労することなく、しかも石英ガラス並みの性能を持ったガラスが作れるわけです。「バイコール(VYCOL)」という名前で商品化されているので、見たことがある人もいると思います。
ガラスの一般的な特徴
「ガラス」と聞いて思い浮かべる特徴としては、硬い、脆い、透明、滑らか、などがあるでしょう。これらの性質の多くは、ガラスの本質である「液体状態がそのまま固まった」ということから来ています。
「硬い」というのは、ガラスだけの特徴ではありません。図2に示した水晶だってクリストバライトだって、みんな「硬い」物質です。この硬さの原因は、原子どうしがしっかりと結びついて固まっていることにあります。ガラスは原子の配列はデタラメですが、原子間の結合は水晶などと同じように非常に強いので、十分な硬さを持つことになるのです。逆に結晶であっても、分子と分子がゆるく引き合って集まっただけの有機物の結晶などはそんなに硬くはありません。
「脆い」「割れやすい」というのもガラスらしい特徴です。壊れやすい物を「ガラスの○○」と例えるぐらいですからね。でも、原子どうしが強固に結び付いているはずのガラスが、どうしこんなに脆いのでしょうか。その原因は、ガラスの表面に目に見えない小さなヒビ割れがたくさん隠れている、ということにあります。このヒビ割れに、押し縮める方向の力がかかってもあまり問題はありません。ところが引っ張る方向に力がかかると、ここに力が集中してヒビ割れがどんどん伸び、ついには割れてしまうのです。結晶の場合は、部分的に構造が乱れたり配列がズレたりした「欠陥」や、方向の違う結晶が接する「粒界」があると、ヒビ割れが成長してもこれらの部分でストップして破壊を止めてしまう場合があります。その点ガラスでは、元々配列がデタラメなのですから「欠陥」や「粒界」は存在しないわけで、一度走り出したヒビ割れの成長は止まりません。このようにして、本来の原子の結びつきの強さの何十分の一程度の力で簡単に壊れてしまうことになるのです。金槌で叩くなどの衝撃を加えた場合も細かく見れば同じことで、叩くことにより瞬間的な変形が起き、引っ張りの力がかかった部分のヒビ割れが一気に成長して破壊に至るのです。逆に、ガラスを固める時に他のものに触れてキズが付くことがないように十分に注意し、固まったらすぐにフィルムを貼るなどして保護してやれば、強度を何十倍にも高めることが可能になります。
「透明」というのもガラスの際立った特徴の一つでしょう。結晶も透明な場合が多いですが、巨大な窓ガラスのように大きな物で、完全に均一・透明というのはめったにありません。その違いは、内部の構造の均一さにあります。
物が「透明」であるためには、可視光線を反射しないこと、吸収しないこと、そして散乱しないこと、の3つの条件が必要です。
結晶の話でも書いているように、金属のような自由電子がない場合は強い反射は起こりませんし、
半導体のような性質がない場合は吸収もあまり起こりませんから、あとは散乱が起こるかどうかで透明性が決まります。この「散乱」は状態が不連続な部分(いろいろな性質が突然変化する部分)で起こりやすく、結晶の場合、方向の違っている多数の結晶が集まっていると、その境目で光が散乱されて白く濁ることが多くなります。大きな結晶ではこのような境目がどうしても発生しやすいので、完全に透明で巨大な結晶というのはなかなか見られないのです。これに対してガラスの場合には、原子の配列がデタラメな状態が全体に均一に広がっていますから、結晶のような境目がありません。キチンと整列していれば、ちょっとした乱れがかえって目立つのに対して、元々乱れた状態であるために、逆に均一性が増すのです。その結果、ガラスの場合にはかなり大きな透明な塊が、結晶よりもはるかに簡単に得られることになります。また結晶の場合は方向によって性質がいろいろ違って来ますが、ガラスではこのような違いもなく、どっちを向いても同じ顔をしています。だからこそレンズやプリズムのような光学部品として使えるわけです。(もちろん、結晶の持つ方向性を積極的に利用した部品もあります)
「滑らかさ」も同様で、均一性が高い分、表面もどこを取っても同じ状態です。余計なデコボコは目立ちません。結晶の面のように「原子レベルでまっ平ら」とは行きませんが、逆に結晶性から来る段差などは発生しませんので、割れた断面などもかなり滑らかになるのです。
この他に、熱や薬品に対する強度が高い、というのもガラスの大きな利点です。透明で丈夫なプラスティックの類もありますが、耐薬品性、耐熱性、という点ではガラスに一歩譲ります。ただし、アルカリに対してはガラスにも弱みがあります。強いアルカリに曝されると、ケイ酸塩を作って溶けてしまうのです。ガラス器具の洗浄にアルカリバスを使ったことがある人もいるでしょう。アルカリバスの液はイソプロパノールなどに水酸化カリウムを溶かした強いアルカリ性のものですが、これなどはガラス表面の汚れを落としていると言うよりも、ガラス表面を汚れもろとも溶かし出しているのです。
温度の急激な変化に対しても、ガラスは必ずしも強くはありません。ガラスコップに熱湯を注いだら割れてしまった、という経験をお持ちの方も多いでしょう。このように温度が急に上がったり下がったりするとガラスが割れることがあるのはなぜでしょうか。それは、表面と内部、表面と裏面など、場所によって温度差ができた場合に、熱による伸び縮みに差が生じて内部に大きな力がかかるからです。この様子を示したのが図3です。
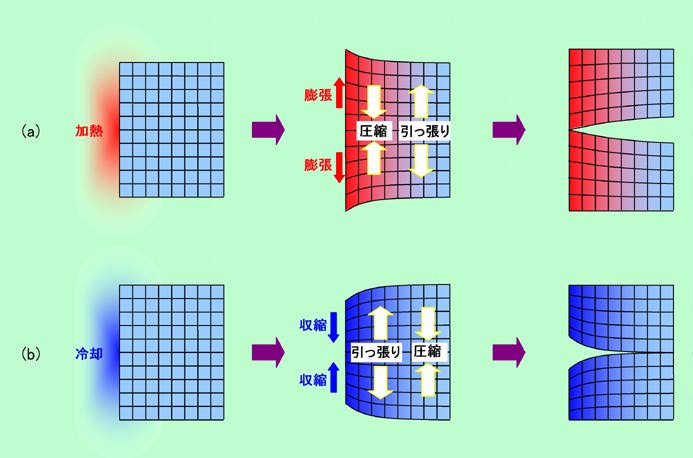
図3 ガラスは急激な温度変化に弱い
図3(a)は低温に置いておいたガラスの左側だけが急に熱くなった場合です。冷えたガラスコップに熱湯を注いだケースなどを考えればよいでしょう。熱くなったコップの内側(つまり図の左側)は急に膨張しますが、その熱はすぐには伝わらないので、右側は膨張しません。左側は伸びようとするのに対し、右側はそうはさせじとがんばるのです。その結果、右側は左側から引っ張られて、内部に引っ張りの力がかかり、一方左側には、右側に引き止められて圧縮の力が働くことになります。先に書いたようにガラスの表面には目に見えない小さなヒビ割れがたくさんありますから、ガラスは圧縮に比べて引っ張りの力に対して極端に弱い、という特徴があります。そのため、右側に引っ張り、左側に圧縮の力がかかる図3(a)のような場合には、右側表面のヒビ割れの部分から一気に破壊してしまうことになるのです。これに対して、コップに熱湯を注ぐのではなく、コップ全体を熱湯の中に放り込んだ場合には少し事情が変わって来ます。この場合、熱くなって膨張するのはコップの内側も外側も含めた表面全体、冷えたままで膨張しないのはガラスの内部、ということになるので、引っ張りの力がかかるのはガラスの内部です。内部では表面のようなヒビ割れの影響はほとんどないですから、この場合はコップはけっこう持ちこたえることになります。
逆に高温のガラスの一部を急冷した場合が図3(b)です。今度は左側が冷えて収縮しますので、それに引きずられて右側には圧縮の力が、反対に左側には、収縮を妨げようとする引っ張りの力が働きます。というわけで、この場合は左側から破壊することになります。冷たい側から裂けて来る、と言う点では図3(a)と同じ、とも言えますね。一方、熱いガラス全体を冷水に放り込んだ場合はどうかと言うと、この場合は表面全体が収縮しようとして、ここに引っ張りの力がかかりますから、表面のヒビ割れが広がって割れてしまうことがあります。このように見て来ると、ガラスは急加熱よりも急冷に弱い、と言えそうですね。これは何もガラスに限ったことではありません。例えば石ころを火で炙ったり水に漬けたりすることを繰り返すとやがて割れて来ますが、この時に割れが大きく広がるのは、熱した時よりも冷やした時の方が多いのです。
脆いガラスを強くする
ガラスの特徴の中で「脆い」「割れやすい」というのだけは、あまりいい性質とは言えませんね。割れるのを防ぐために何枚ものガラスを貼り合わせたり保護フィルムを貼ったり、という手段も採られますが、これはガラスそのものを強くしているわけではありません。そこで何とかガラス自体を強くしようと考え出されたのが「強化ガラス」です。この強化ガラスの元祖は、「オランダの涙」とか「プリンス・ラパートの滴(Prince Rupert's drops)」とか呼ばれる、ある面白い性質を持ったガラス玉です。これは、図4のようにして簡単に作ることができます。
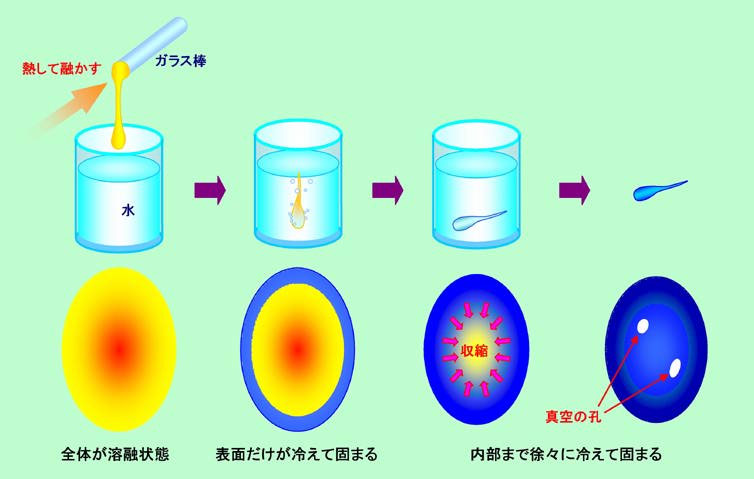
図4 「オランダの涙」を作る
まず、ガラス棒などをバーナーで熱して融かします。ステンレスなどの容器に水を張り、この中に融けたガラスの滴を糸を引くように落とすと、オタマジャクシのような形のガラス塊ができます。これが「オランダの涙」です。たったこれだけのものなのですが、その中では、図4の下側に示しているように、いろいろ複雑な現象が起こっています。
ドロドロに融けたガラスを水の中に落とした瞬間、ガラス滴の表面は一気に冷えて固まります。水の温度が低すぎたりすると割れることもありますが、うまく行けば、中に熱い液体を含んだカプセルのような状態で固化させることができるのです。その後、内部も徐々に冷えて固まって来ます。この時、内部は収縮しようとしますが、外側が既に固まっているので、外から引っ張られて自由に縮むことができません。結局、内部には非常に強い引っ張りの力が、また表面は内部から内向きに引かれて非常に強い圧縮の力がかかった状態で、大きな歪を残したまま全体が固まることになります。場合によっては、内部が強引に収縮するために真空の空孔ができることもあります。
ガラスの最大の弱点は、表面にある細かいヒビ割れの影響で引っ張りの力に極端に弱い、ということでした。ところが「オランダの涙」では、その表面に強い圧縮力が働いていますから、少々引っ張られてもビクともしません。実際、金槌で叩いても簡単には割れないのです。ところが、オタマジャクシの尻尾の部分をペンチなどで挟んでポキッと折ると、全体が一瞬にして砕け散ってしまいます。尻尾を折ることで内部にまで亀裂が入ることになるのですが、ここには非常に強い引っ張りの力がかかっていますから、亀裂がアッという間に全体に広がってしまうのです。この時の割れ方も特徴的で、普通のガラスが割れた場合のような鋭利な破片はできません。亀裂が縦横に細かく走るので、海辺の砂のような粉々な状態になります。非常に強い反面、壊れるときは華々しく、という感じです。
この「オランダの涙」と同じ方法で強度を高めたのが「強化ガラス」です。実際には水に漬けるのではなくて、加熱したガラスの表面に冷たい空気を吹き付けて急冷するのですが、原理は全く同じです。当然、性質も同じで、普通のガラスの何倍も強い反面、壊れる時には全体が木っ端微塵になってしまいます。このような特徴を持っていますから、ショーウィンドウ用のガラスとか、高層ビルの壁、ガラステーブルなどによく使われています。強い上に、万が一割れても、危険な破片ができないからです。一方で、防犯用としては必ずしも適当とは言えません。確かに強いのですが、絶対に割れないというほどではありませんし、鋭利な破片ができないのですから、割った窓から侵入する泥棒にとっても安全、ということになってしまいます。
衝撃に対する「脆さ」の他に、ガラスは温度の急激な変化にも弱い、ということは既に説明しました。その原因は温度変化による膨張・収縮なのですが、これはガラスの種類によってずいぶん違います。図5に、いろいろなガラスの熱膨張の度合いを示しました。
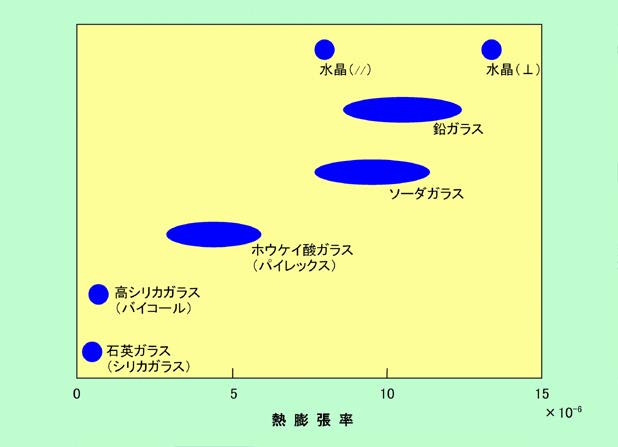
図5 いろいろなガラスの熱膨張率
ここでの熱膨張率と言うのは、温度を1℃上げた(下げた)時にどのくらいの割合で伸びる(縮む)かを示す数値で、例えば熱膨張率が10×10
-6の場合は、長さ1mの棒の温度が1℃上がると0.01mm(=10μm)伸びる、ということを表しています。この図からわかるように、同じガラスでも熱膨張率は10倍以上も違うのです。もちろん熱膨張率が低い方が温度変化には強いわけで、この中では石英ガラスがNo.1、シリカ分の多い高シリカガラスがこれに続きます。実際に石英ガラスの場合、1000℃ぐらいに熱した物を急に水に入れても、ほとんど割れることはありません。またホウケイ酸ガラスも、加工がしやすいガラスの中では優秀な方です。化学実験器具はもちろんのこと、食器などにも使われていて、家庭用のガラス容器で「耐熱ガラス」と呼ばれているのは、ほとんどがこのホウケイ酸ガラスです(「硬質ガラス」と呼ばれる場合もあります)。
このような普通のガラスの他に、特殊な方法で熱膨張を極端に小さくしたガラスがあります。セルビット(CERVIT)やゼロデュア(ZERODUR)などの商品名で知られる「結晶化ガラス」、あるいは「部分結晶化ガラス」と呼ばれるもので、リチウムやアルミを含んだガラスに特殊な熱処理を施して、内部に微細な水晶の結晶を析出させたものです(その意味では既に「ガラス」ではないとも言え、「ガラスセラミックス」などとも呼ばれます)。普通のガラスは温度を上げれば膨張しますが、結晶化した部分は逆に温度を上げると収縮する性質があり、互いにキャンセルし合うことで、全体の熱膨張をほとんどゼロにできるのです。ただし、ガラス部分にしても結晶化部分にしても、膨張・収縮の度合いは温度によってそれぞれ変化しますから、あらゆる温度で膨張を完全にキャンセルすることはできません。そこで通常は、室温付近で膨張率が最小になるように、結晶化をコントロールしています。一般的には結晶化した部分は全体の70〜80%で、結晶の大きさは50nmぐらいのようです。その膨張率はどのくらいかと言うと、例えば0℃〜50℃ぐらいの範囲で、長さ1mの普通の石英ガラスが1℃あたり0.5μm伸び縮みするのに対して、結晶化ガラスではその1/10の0.05μm程度に抑え込むことができます。ソーダガラスなどと比べると1/100以下ですね。
ところで、ここで疑問が出て来るかもしれません。ガラスが温度を上げると膨張する(つまり膨張率が正の数)、というのはわかります。しかし結晶でもそれは同じはず。中には温度を上げると収縮するような、負の膨張率を持つ特殊な物質(例えばタングステン酸ジルコニウムとか、4℃以下の水とか)もありますが、図5にも示したように水晶の膨張率はかなり大きな正の値です。これはどういうことでしょうか。その答は、水晶が高温型と低温型の2種類の結晶を作ることにあります。
結晶化させる時に最初にできるのは高温型の水晶です。これを徐々に冷やして行くと、水晶は密度の大きい(体積の小さい)低温型に変わる・・・・はずでした。ところが、結晶化ガラスの中の水晶は周りをガラスでガッチリ固められていますから、自由に変化することができません。結局、小さくなりたいのになれない、非常に中途半端な状態で取り残されることになります。このような状態にあるガラスを暖めてみましょう。ガラス部分は当然のように膨張します。すると結晶部分は周囲から押されることになりますから、これ幸いと収縮して本来の状態に近付こうとします。その結果、膨張と収縮が相殺されて、全体としては膨張も収縮も見られなくなるのです。
この結晶化ガラスは温度が変わっても寸法が変化しないわけですから、精密な光学部品によく使われます。ただし、ガラスの中に微細な結晶が埋め込まれているので、粒子の大きさが光の波長の1/10しかないとは言え、やはり光の散乱は起こります(ソーダガラスなどを長時間高温で加熱していると曇って来る「失透」という現象がありますが、実はこれも、内部に微細な結晶が発生するためです)。そのためレンズやプリズムのように光が中を通る用途には不向きで、主な使い道は鏡の材料ということになります。特に、
天体望遠鏡に使われる凹面鏡や凸面鏡の材料として有名です。また、加熱しても割れにくいという特徴を活かして、電磁調理器の上板や電子レンジ用の棚、ボイラーの覗き窓などにも利用されています。
なお聞くところによると、最初の結晶化ガラスとして有名なセルビットは元々は香水のビン用として開発されたものだそうです。香水のビンの口には小さな孔が開いており、ここから中の香水が出て来るのですが、温度の変化で孔の大きさが変わると出て来る量が一定しなくなります。そこで熱膨張しない結晶化ガラスが使われた、ということです。
レンズやプリズムの材料 ― 光学ガラス ―
透明性や均一性という特徴を活かしてガラスが大活躍するのが、光学ガラスの分野です。窓ガラスやガラスビンなども光の透過性を利用していると言えばその通りなのですが、やはり
光学機器に用いる光学ガラスの分野が真骨頂でしょう。ここでは普通のガラス以上に透明性・均一性が求められることは当然ですが、その他に光の「屈折」と「分散」にかかわる性質がポイントになります。
ガラスによる光の屈折は、光の速度がガラスの内部で遅くなるために、斜めに入って来た光の進路が折れ曲がる現象で(図6左)、この度合い(折れ曲がりの強さ)を表すのが「屈折率」です。ガラスの屈折率は成分によって変わることが知られており、鉛やバリウム、ランタンなどが入ると高くなり、フッ素やチタンなどが入ると低くなります。

図6 光の屈折と分散
もう一つの要素である「光の分散」は、波長によって屈折率が異なるという現象で、これによって虹ができることは説明するまでもないでしょう。普通は図6右のように、波長の長い光(可視光線で言えば赤い光)ほど屈折率が小さく、波長の短い光(青い光)ほど大きくなります。この分散の度合いを表すには、青い光の屈折率と赤い光の屈折率を比べればよいわけですが、ただ単に差をとっただけだと、屈折率そのものが大きい材料では値が大きくなってしまいます。そこで中間の緑や黄色の光の屈折率を使って補正し(正確には、屈折率から1を引いた値で割り算し)、屈折率の影響をキャンセルした値を使います。これが「分散率」ですが、普通は分散率そのままではなくて、これの逆数であるアッベ数が使われることが多いようです。逆数ですから、アッベ数が大きいほど分散が小さい(波長による屈折率の差が小さい)材料、ということになります。このアッベ数もガラスの成分で変化し、鉛が入ると小さく、バリウムやリンが入ると大きくなる傾向があります。
光学機器に望みの性能を発揮させるには、それを構成するレンズなどの屈折率やアッベ数を厳密に選ばなければなりません。様々な特性を持ったガラスを複雑に組み合わせることで機器の性能を格段に高められるのです。
天体望遠鏡の話に書いた色消しレンズなどはその最も簡単な例と言えるでしょう。そのため、いろいろな屈折率やアッベ数を持った光学ガラスがたくさん開発されています。
19世紀前半に作られた最初の光学ガラスが、クラウンガラスとフリントガラスです。クラウンガラスはソーダガラスの親戚のようなものですが、ナトリウムではなくてカリウムとカルシウムを含んでいます。融かした時の粘性が非常に高く、型に流し込んだ際に、閉じ込められた気泡のせいで王冠(クラウン)のように膨らんだりすることから名付けられたそうです。このガラスは、屈折率はそこそこですがアッベ数は大きめ、つまり分散は小さめであることが特徴です。一方のフリントガラスは鉛ガラスの一種で、ケイ素と同じぐらいの大量の鉛を含んでいます。その結果、屈折率もやや大きいですが、特に分散が大きいことが際立った特徴となっています。ちなみに、フリントガラスの名前は、原料である火打石(フリント="Flint")から来ています。これらのガラスは「旧ガラス」と呼ばれていますが、現在も光学ガラスの基本であることに変わりはありません。何千種類もあると言われる現代の光学ガラスでも、アッベ数の大きい物は「○○クラウン」、アッベ数の小さい物は「××フリント」という名前が付けられています。
ガラスメーカーからは、これらの様々な光学ガラスを屈折率とアッベ数を目盛ったグラフ上に示した図が出されています。これを思いっきり簡略化したものを図7に示しておきました。基本となるクラウンガラス、フリントガラスに対して、いろいろな元素を添加して特性を変えていることがわかると思います。ただし注意が必要なのは、光学ガラスの特性は屈折率とアッベ数だけでは示せない、ということで、実際の光学機器の設計ではもっと細かい性質まで考慮する必要があります。例えば、波長による屈折率の変化が通常のガラスとは大きく異なる「異常分散」という性質を持ったガラスがありますが、これなどは図7のようにアッベ数だけを考えていたのでは見えて来ません。こういう細かい特性まで考慮した設計をすることは高性能の光学機器を作るには絶対に必要で、現実に「異常分散」を持ったガラスは、望遠鏡やカメラなどでレンズ系のいろいろな収差を補正するのに抜群の効果を発揮しています。
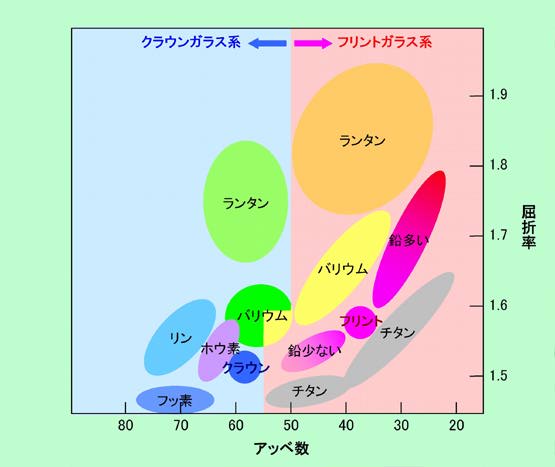
図7 いろいろな光学ガラス
ガラスの作り方あれこれ
ガラスを作るには、とにかく材料を熱して融かし、冷やして固めればよいわけですから、固める前に整形すれば望みの形にすることができます。最も簡単なのは、型の中に流し込んでそのまま固める方法ですが、ただ流し込むだけではなくて、型を回転させて遠心力で型の周辺に押し付けて固めたり(テレビのブラウン管など)、空気を吹き込んで薄いビンにする、などの工夫がされています。一方、棒状や管状のガラスを作るのには、融けたガラスを丸孔から引き出す、などの方法が採られます。
いろいろ変化があって面白いのは、板ガラスの製法です。図8に、代表的な板ガラスの製法の概略を示しました。
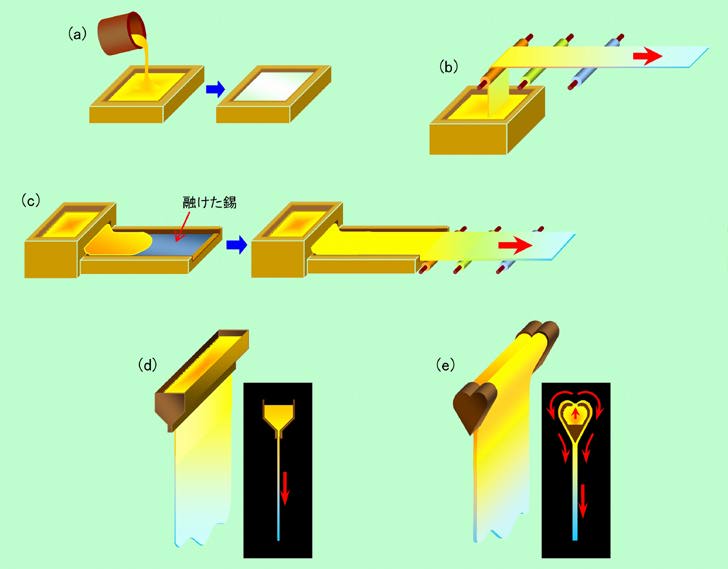
図8 板ガラスの製法いろいろ
(a)は、ただ型に入れて固めるだけの単純な方法で、寸法や表面の滑らかさなどは全て型の精度で決まってしまいます。この方法ではガラスは1枚1枚個別に作ることになりますが、複雑な形をした製品ならともかく、板ガラスを1枚ずつ作るというのは、どう考えても効率のよい方法とは言えません。そこで(b)のように融かしたガラスを引っ張り上げ、横方向または上方向に連続で流しながら冷やし固める、という方法が考え出されました。これによって生産性はグッと上がりますし、ガラスを引き出した後のローラー部分の表面を平滑に仕上げておけば、そこそこ平坦で滑らかな表面を持った板ガラスを作ることができます。それでも、本当に平坦で滑らかな表面に仕上げるのはなかなか難しく、用途によっては後から磨き直す必要もあります。この問題を解決するのが、(c)の錫(スズ)を使った方法です。錫はガラスが固まるよりも低い温度(232℃)で融けますから、錫を液体にしておいて、その上に融かしたガラスを流せば、本当に真っ平らな面を持った板ガラスになるのです。面精度が良い上に大量生産も可能ですから、今では窓ガラスなどに使われる板ガラスの大部分はこの方法で作られています。この製法の欠点は、錫側と空気側でガラスの状態が多少違う、つまり裏表があるということです。パッと見はわかりませんが、波長の短い光の散乱などには若干の差があるようです。また微量ではありますが錫に接していた面にはどうしても錫が残りますので、最近の薄型ディスプレイ用のガラスなどでは具合が悪い場合もあるようです。
(b)や(c)の方法は、引っ張り上げたりローラーの上を滑らしたりする関係で、ガラスにある程度の強度が要求されます。そのためコンマ何ミリ、というような極薄のガラスを作るのは困難です。そこで極薄の板ガラスを作る場合には、(d)のように窯底のスリット状の穴から融けたガラスを流し出して成型する方法が採られます。一見、仕組みも単純で簡単なように見えますが、ムラや欠陥なく薄いガラスを作るのは非常に難しく、高度な技術が必要とされます。この方法で作られるガラスとしては、身近なところでは顕微鏡観察用のカバーグラス(厚さは0.15mmぐらい)がありますが、その他にディスプレイのタッチパネル用(厚さは0.2mmぐらい)などが主な用途です。変わったところでは人工衛星の太陽電池パネルの表面保護用などが知られており、厚さは何と0.05mmだそうです。
ここまでの製法ではいずれも、ガラスの表面が窯の壁や融けた錫などの部材に接触しており、それらの影響を避けることができません。そこで、どうしても表面を余計な物に触れさせたくない場合には、(e)のようなちょっと変わった方法が採用されます。パッと見は(d)の方法と似ていますが、スリットが窯底ではなくて上側にあります。このスリットから出たガラスが左右に分かれて流れ出し、下側で合わさって一枚の板になるのです。このようにすると、窯に触れた部分は内側に閉じ込められて表に出て来ませんから、表面の純度・精度が要求されるディスプレイ用途などに好都合なのです。
融かして固める以外にも、ガラスを作る方法があります。一つはガス状の原料を分解して作る気相合成法、もう一つは液体状の原料を反応させて作るゾルゲル法です。気体や液体の原料は、普通の固体原料と比べて純度を高くするのが容易ですから、これらの方法を使えば非常に高純度の、望みの成分以外は何も入っていないようなガラスを作ることができます。その反面、固体原料を融かして固めるのと比べて原料は高価ですし製法も複雑なので、よほど価値の高い物を作らなければ、コスト的に割が合わなくなります。
気相合成法はケイ素を含むガス状の原料(四塩化ケイ素など)を燃やして二酸化ケイ素にする方法で、非常に高純度で透明度の高いガラスを作ることができます。また、ガス状の原料さえ手に入れば、これらを一緒に燃やすことで望みの成分をガラスに混ぜ込むことも可能です。ただし、これらの原料には毒性の強い物が多く、たいていは空気中の水分とすぐに反応してしまいますから、内部を真空にできる密閉された大掛かりな反応設備が必要です。また、できるガラスは「薄膜」というレベルのものになりますので、用途は特殊なものに限られます。例えば、石英管の内側にゲルマニウムを含む原料ガスを流して気相合成法でガラスを積もらせると、内側がゲルマニウムを含んだ高屈折率のガラス、外側が石英、という二重構造の、非常に透明度の高いガラス棒ができます。これを融かして引き伸ばせば、二重構造そのままに細い糸状になり、光ファイバーができるのです。
ゾルゲル法の場合は原料は液体で、ケイ素の4本の手に酸素を介して有機基がつながったアルコキシドと呼ばれる物質が基本です(そのままで液体の場合もありますし、アルコールなどに溶かした溶液になっている場合もあります)。これが水と反応すると有機基がはずれて水酸基になり(いわゆるケイ酸の状態)、さらに隣の水酸基と反応して、(ケイ素)―(酸素)―(ケイ素)、というネットワークができます。初めのうちは顕微鏡でも見えないような小さな粒子(ゾル)ができ、やがてこれがつながってゼリー状の塊(ゲル)になることが多いので、ゾルゲル法と呼ばれるのです。
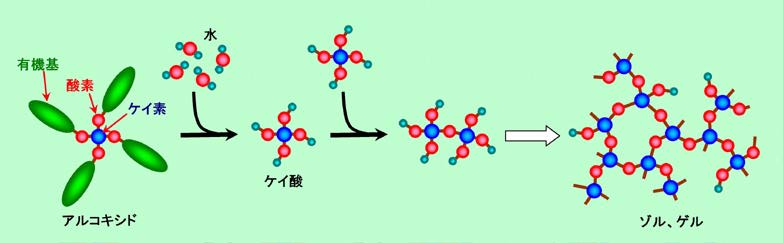
図9 ゾルゲル法の基本的な反応
ゲルの状態ではまだ水などの溶媒を多量に含んでいます。これを加熱して乾燥させると、水が抜けた孔がたくさん開いたシリカゲル(乾燥剤として有名なアレ)になり、さらに加熱して焼き固めるとガラスになります。もちろん、液体原料に添加成分を混ぜ込んでおけば、いろいろな組成のガラスを作ることも可能です。この方法の利点は、気相合成法ほどではありませんが純度の高いガラスが作れること、そして反応がほとんど室温で、さほど大掛かりな設備なしにできることでしょう。ただし、最後に加熱してガラスにするところで相当に収縮しますから、成型品を作るのには向いていません。やはり塗布した後で焼き固めて薄膜を作るような用途に使われることが多くなります。
本当に液体のガラス ― 水ガラス ―
最後に、「水ガラス」と呼ばれる液体の話をしましょう。正式には「ケイ酸ナトリウム」という化合物の水溶液のことで、水飴のようにドロッとした、無色透明の液体です。ケイ酸ナトリウムは二酸化ケイ素と水酸化ナトリウム、または二酸化ケイ素と炭酸ナトリウムを一緒に高温で融かすことで作られ、二酸化ケイ素にナトリウムと酸素が入り込んだ形になっています(ケイ酸ナトリウムができる過程で、水酸化ナトリウムを使った場合は水が、炭酸ナトリウムを使った場合は炭酸ガスが抜け、ナトリウムと酸素が2対1の比率で入って来ます)。その組成はビシッと決まっているわけではなくて、ナトリウム(と酸素)がどのくらい入るかで、状態はいろいろ変化します。
普通のガラスは、図10(a)のように主成分のケイ素と酸素がガッチリとネットワークを作っています(もちろん結晶ではありませんので構造は乱れていますが、ここではわかりやすくするために整然とした配置に描いています)。ここにナトリウムと酸素が入って来ると、図10(b)のように酸素が負イオンになって(ケイ素)―(酸素)の結合が切れ、ネットワークが途切れます。その結果、ガラスは軟らかくなり、またより低い温度で融けるようになります。これがソーダガラスの状態です。ここにさらに多くのナトリウムが入ると、鎖がいたるところで切れていっそう軟化が進み、ついには水に溶けるようになって来ます(図10(c))。この状態がケイ酸ナトリウムであり、これを水に溶かしたのが水ガラスです。図に模式的に描いているように、ケイ酸ナトリウムは多くの場合、きっちりと決まった分子の形を持っていません。長いものや短いもの、枝分かれしたものなどいろいろです。そしてナトリウムの量が増えるほど鎖の切れ目が多くなりますから、各断片はより小さく、水溶性もより高くなって行きます。

図10 ガラス中のナトリウムが増えると水溶性になる
ナトリウムがさらに増えてケイ素の数の2倍になると、図10(d)のような決まった形が現れます。これはメタケイ酸ナトリウムと呼ばれるもので、他の比率がデタラメなケイ酸ナトリウムと違って結晶を作ることもできる、かなり安定な形です。また、ナトリウムがケイ素の4倍まで増えると、図10(e)のようなオルトケイ酸ナトリウムができることが知られています。
これらのケイ酸ナトリウムを水に溶かした水ガラスは、いずれも強いアルカリ性を示します。末端の酸素イオンの一部が水から水素イオンを引き抜いて水酸化物イオンを残すからで、結果的には末端の酸素の先に水素が付いたもの(いわゆるケイ酸)と水酸化ナトリウムの水溶液になります(図10(f))。先に「ガラスは強いアルカリに溶ける」と書きましたが、この状態はまさに、ガラスを水酸化ナトリウム水溶液に溶かした状態なのです。ちなみに、陶芸に使われる釉薬も水ガラスの親戚のようなものです。釉薬は普通は長石などの天然の鉱物と藁灰などを混合して作られますが、鉱物の主成分はケイ素やアルミの酸化物であり、藁灰などにはナトリウムをはじめとするアルカリ成分が含まれています。ですからこれを焼物に塗って窯で焼くと、アルカリ分が鉱物に入り込んでケイ酸ナトリウムなどの融けやすい成分が作られ、これが実際に融けて焼物の表面を覆い、ガラス状に固まるのです。
水ガラスに酸を加えると中和が起こり、ほとんどのケイ酸ナトリウムが水素イオンを捕まえてケイ酸になります。それだけにとどまらず、ケイ酸の水酸基どうしが反応して(ケイ素)―(酸素)―(ケイ素)という結合ができ、互いに連結してネットワークを作ります。つまりゲル状になるのです。どこかで聞いたような話ですね。そうです。アルコキシドを使ったゾルゲル法と同じなのです。ケイ酸ナトリウムを中和してできるケイ酸と、アルコキシドが分解してできるケイ酸とは構造的に差はありませんから、その後の反応は当然同じになり、乾かせばシリカゲルになるし、さらに焼き固めればガラス状の固体が得られるのです。ただし水ガラスを原料にした場合は、多量のナトリウムと中和に使った酸の成分を含むことになりますから、中和した後でイオン交換などで余分なイオンを除去することが多いようです。
液体から固体に変化し、しかも固化したものはガラス質ですから強度もあって熱にも強い、ということで、水ガラスはいろいろなところで使われています。例えば、焼き物の材料を捏ねる時に混ぜ込むと、粘度が下がって扱いやすくなり、焼いた後はガラス状になって粘土の粒子をしっかり固定する接着剤の役目を果たします。軟弱な地面を固めるのにも有効ですし、建材などで耐熱性や耐火性のある塗料や接着剤としても活躍しています。
そんな中で、実用的とは言えませんが、水ガラスを使った面白い実験があります。「ケミカルガーデン」と呼ばれているもので、学校の化学クラブなどが展示品としてよく出していますから、見たことがある人もいるでしょう。試験管に入った透明な液体の中で、青や黄色の木の枝のようなものがニョキニョキと伸びているヤツです。この透明な液が水ガラスで、いろいろな色の枝の元になっているのは、硫酸銅や塩化コバルト、塩化鉄などの様々な金属塩です。
ケミカルガーデンは、適当に薄めた水ガラスに金属塩の粒を沈めて数日放っておくだけでできます。その仕組みを図11に示しました。
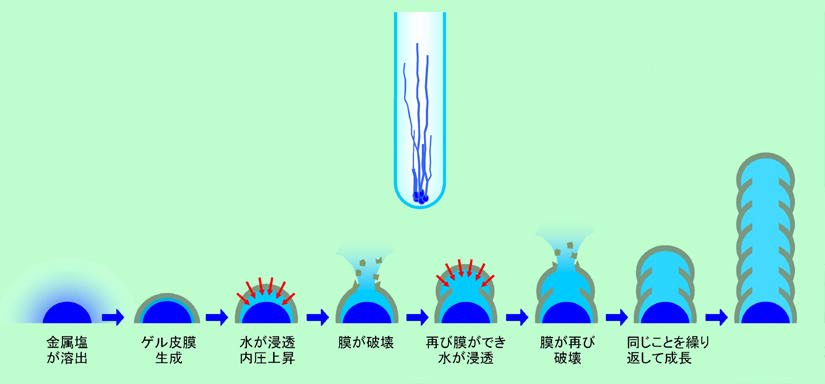
図11 枝がニョキニョキ伸びるケミカルガーデン
水ガラスに沈めた金属塩は表面から徐々に溶け出しますが、金属塩は弱い酸性なので、その付近が酸性に傾きます。すると水ガラスは中和されてゲル化を起こし、金属塩の表面に皮膜を作ります。この時、皮膜を挟んで外側はただの水ガラスですが、内側は濃い金属塩の溶液になっていて、濃度の差ができています。一方、皮膜の方は、前にも書いたように多量の水を含んでおり、水の通り道を持っている、つまり水を通す性質があります。このように水を通す性質を持った膜を挟んで濃度の差ができると、その差を小さくしようとして、濃度の低い方から高い方へ水が移動する「浸透」という現象が起こります。ここでは皮膜の外側から内側に水がどんどん入って来ることになるのです。その結果、入って来た水のために膜の内側の圧力が上がり、ついには膜を突き破って、内部の金属塩溶液が外に出て来ます。出て来た金属塩溶液は酸性ですから、ここで再び水ガラスの中和が起こり、またゲルの皮膜ができます。あとは同じことで、皮膜が破れて液が漏れ出しては新しい皮膜を作る、ということを繰り返し、どんどん枝が伸びて行くのです。枝の内部は金属塩の溶液ですから、それぞれの金属に応じた色が付きます。主なものでは、銅の青、ニッケルの緑、鉄の黄色などがあります。
内側の液が膜を突き破る時には、外から膜を押さえつけている水圧に逆らって出て行く必要があります。そのため、水圧の低いてっぺんが最も破れやすく、枝は上に向かって伸びることになります。しかし実際には、金属塩の粒の形や液の微妙な揺らぎなどの影響で、膜の強度はどこでも同じというわけではありません。その結果、必ずしも真上ばかりが破れるとは限らず、変な方向に伸びたり、枝分かれしたりするケースも出て来ますので、多少いびつな、いかにも自然っぽい独特の形になるのです。
雑科学ホーム
hr-inoueホーム











