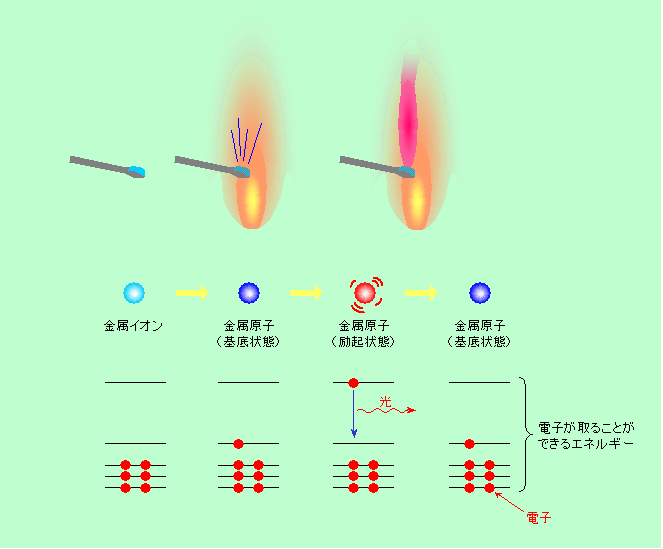雑科学ホーム
hr-inoueホーム
● 発光の話 ●
発光はエネルギーの放射
発光とは文字通り「光」を「発する」ことですが、ここで言う「光」は、何も目に見える「可視光線」だけを指すのではありません。紫外線や赤外線はもちろんのこと、紫外線よりも波長の短いエックス線やガンマ線、赤外線よりも波長の長いマイクロ波や電波も含めた、電磁波全体のことを指します。これらの電磁波は全てエネルギーを持っており、エネルギーを電磁波の形で放り出すことを「発光」と言うのです。
我々の身の回りには、いろいろなものから放り出された、たくさんの「光」が飛び交っています。図1にその種類をザッとまとめてみました。

図1 いろいろな「光」
波長10kmを超える電波から、原子よりも小さい波長のガンマ線まで、十数桁にわたって広がっていますが、どれも同じ光(電磁波)です。こうして見ると、人間が見ることのできる可視光線の領域がいかに狭いかがよくわかります(とは言っても地表に届く太陽の光はほとんどが可視光線の領域にありますから、地球上で暮らす限りはこれで問題ありませんが)。言うまでもないと思いますが、波長が短いほどエネルギーが大きくなります。電波と呼ばれる領域の光は金属の中の自由電子を揺り動かす程度で、物質にはほとんど影響を与えませんが、赤外線になると分子を振動させて温度を高めます。可視光線では、目の奥にある物質を刺激してちょっと変化させることができ(これが光が「見える」ということです)、紫外線では分子の中の結合を切断したりして化学反応を起こさせることが可能になります(日焼けとか殺菌とか)。エネルギーが非常に大きいエックス線やガンマ線は、ご存知の通り、いろいろなものを突き抜けてしまいますから、レントゲン撮影や、体の内部のがんの治療などにも使われています。
閑話休題、これらの光はどのようにして飛び出すのでしょうか。エネルギーを持った光が出て来るということは、どこかで同じ大きさのエネルギーを失っているということです。つまり、高いエネルギーを持つ状態から低いエネルギーの状態に落ち込む時に光が出るわけで、それにはいろいろなパターンがあります。それらを全て網羅することはできませんが、この記事では、可視光線を中心にいくつかの例を拾ってみることにします。
熱から光へ ― 黒体輻射 ―
電熱線に電流を流してみましょう。初めはただ熱くなるだけですが、電流を増やして行くと温度もどんどん上がり、やがて赤くなって来ます。さらに電流を増やすと電熱線は明るさを増し、色も赤から黄色へと変わります。もっと電流を流すと、全体が白く輝くようになります。このへんになると、眩しくてまともには見ていられないでしょう(電熱線が焼き切れるかも)。同じことは白熱電球のフィラメントでも起こっています。なぜこのような光が出るのでしょうか。この場合、電気のエネルギーが直接に光に変わっているのではありません。電気のエネルギーはまず熱に変わり、この熱が光に変わっているのです。
温度が高いということは多くの熱エネルギーを持っているということであり、ミクロに見れば、物を構成している原子や分子が高速で飛び回ったり、激しく振動したりしている状態です。激しく動いている原子や分子が、それよりもいくらかおとなしい状態に変化すると、余ったエネルギーが光として放出され、逆に他の原子や分子が放出した光を吸収すると、激しく動く状態に飛び上がります。物体の中ではこのような光のやり取りが頻繁に起こっていて、そのうちのいくらかは外にも飛び出してきます。これが高温の物体から放たれる光の正体です。
温度が低いうちは目に見える光は出ず、もっとエネルギーの小さい赤外線が出て来ます。赤外線は他の物に吸収されて熱に変わる(吸収した相手の原子や分子を振動させる)性質が強いですから、光は見えなくても、手を近づければちゃんと暖かさを感じます。コンロもコタツも赤外線ヒーターも、みんなこれを利用しています。温度が高くなって来ると、次第にエネルギーの大きい、波長の短い光が多くなって来ますから、赤い光が目に見えるようになります。さらに温度が高くなると、より波長の短い黄色や青の光が出るようになり、先に書いたような色の変化を起こすのです。つまり、放たれる光の波長(色)は、温度で決まる、ということです。
温度を何度にするとどんな色の光が出るか、ということには、古くから関心が持たれていました。ただし、理科の実験や花火の着色でおなじみの炎色反応のように、元素の種類によって特別な色が出たり、元々の物体に色が付いていたり(言い換えれば、特定の色の光を反射する性質を持っていたり)すれば、純粋に温度だけの影響を見ることができません。そこで、色のない、真っ黒な物体が考えられました。外から来た光は一切反射せず、もちろん炎色反応のような特殊な発光もしません。これが「黒体」です。なかなか条件が厳しいですが、密閉容器の一箇所に小さい孔を開け、そこから中をのぞくと、ほぼ理想的な黒体に近い状況になるようです。中で光は反射しながら行ったり来たりしますが、孔からはほとんど出て来ないので、中は真っ黒に見える、というわけです。このような黒体を一定温度にした時に出て来る光の波長を調べると、図2のように温度によって特定の波長分布になっていることがわかります。これが「黒体輻射」です。ちなみに、白熱電球は完全な黒体ではありませんが、その波長分布を見ると、だいたい2500〜3000Kの黒体輻射に近い形になっています。本サイトの
色の話にも、この黒体輻射の波長分布を示す同じグラフを載せています。
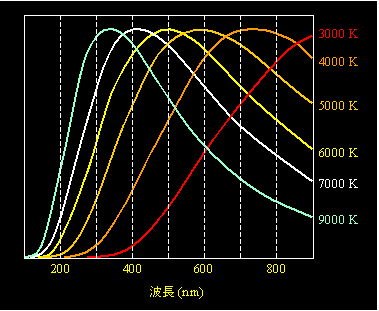
図2 黒体輻射の波長分布
高温になると原子や分子の動きが激しくなってエネルギーの大きな短波長の光が出る、ということで納得してしまえばそれだけなのですが、実はこの黒体輻射、その後とんでもない大発見につながります。
色の話にも書いたように、
量子論の発端となったのです。面白い話なので、少し紹介しておきましょう。
黒体輻射の波長分布(スペクトル)を理論的に説明しようという試みがいろいろされました。ところがどうしても実験結果と合いません。そこで、理論から導くのではなく、とりあえずは実験結果に合うように式を決めてみよう、ということになりました。そうして出て来た式は、かなりいいところまで行ったのですが、あと一歩届きません。また、その式を説明できる理論も見つかりませんでしたので、あまり注目されませんでした。ところが・・・・、ある人が、この式にほんのちょっと細工を加えると実験結果にピッタリ合うことに気付いたのです。ここで式を出したいところですが、このサイトでは数式は使わない約束ですから、頑固にそれを守って、言葉だけで説明しましょう。その式は、一定の規則で並んだたくさんの数値を足し合わせた形になっていたのです。
黒体から出て来る光はいろいろなエネルギーの光の寄せ集めです。波長もいろいろですが、同じ波長の光で見ても、その強さはいろいろで、弱い光から強い光まで、びっしりと隙間なくつながっていると考えるのが普通でしょう。それまでの理論も、このような考え方で作られていました。ところが、それが一定の規則で並んだたくさんの数値の足し合わせで表される・・・。これは大変なことでした。エネルギーは連続ではなく、飛び飛びだと言っているのです。ある波長の光のエネルギーには基本になる単位量があり、その1倍、2倍、3倍、・・・、という値しか持つことができない、つまり光は1個、2個、3個・・・と数えられる粒のような性質を持っていたわけです。この単位量が「量子」(光の場合は「光子」)であり、ここから量子論が始まったのです。19世紀の終わりごろのことで、足し合わせの式を発表したのが、有名なマックス・プランクです。
元素特有の発光 ― 炎色反応 ―
先ほどの黒体輻射では邪魔者として出て来た炎色反応ですが、発光現象としては非常に身近なものです。理科の実験で、炎の中に金属塩の水溶液を付けた白金線などを入れると、含まれている元素特有の色が出る、アレです。花火に着色するのにも、この炎色反応が使われています。これは、炎の中で金属塩が分解してできたガス状の金属原子が、炎の熱によってエネルギーの高い状態(励起状態)に飛び上がり、それが元の低エネルギーの状態(基底状態)に落ちる時に光を出すものです。その仕組みを図3に模式的に示しました。図の一番下は、原子が持っている電子のエネルギーを表しています。(電子のエネルギーに関しては
化学結合の話参照)
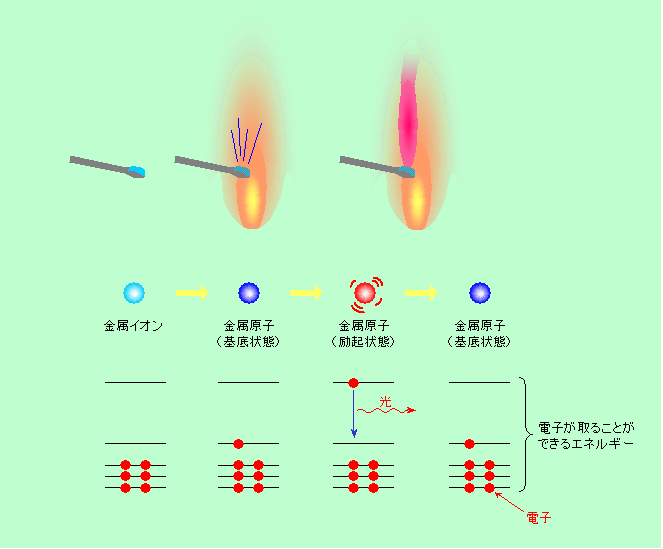
図3 炎色反応の仕組み
初めは水溶液ですから、金属はイオンとして溶けています。これを高温の炎の中に入れると、水が急激に蒸発し、金属イオンは飛び散り、その辺にいる電子を捕まえて中性の原子になります(炎の中にはたくさんの電子やイオンが飛び交っていますから)。この金属原子の中の電子が熱によって高いエネルギー状態に飛び上がり、それが再び元の状態に落ちる時に、その落差に相当するエネルギーを持った光を発するのです。先の黒体輻射では発光の元は原子や分子の運動のエネルギー、つまり熱そのものでした。しかし炎色反応では、一番初めの源は熱エネルギーなのですが、直接に発光にかかわるのは電子のエネルギーなのです。
よく、「金属イオンの炎色反応」という言い方をしますが、厳密に言うとこれは間違い。イオンでは炎色反応にかかわる外側の(エネルギーの大きい)電子がありませんから、発光しないのです(原子ではなくて塩化物などの分子の状態で発光する場合もあります)。それでは、初めからイオンではなくて金属の塊を使えばよいかというと、そうも行きません。金属の塊の中では電子が取ることができるエネルギーは図3のようなはっきりした位置にはなく、互いに影響し合ってボワッと広がってしまいますから、ある程度離れたエネルギー間を電子が一気に飛び移って発光する、ということができないのです。また、塊を構成する個々の原子に熱を効果的に伝えられない、という問題もあります。もっとも、金属が蒸発するくらいに強烈に加熱してやれば、蒸発した金属は原子状ですから光らせることはできますが、普通の炎のレベルでは無理です。というわけで、やはり炎色反応を見るには、溶液の状態にして個々のイオンを一旦ばらばらにした上で、これをいきなり炎の中に放り込んでやることが必要なのです。
言うまでもなく、炎色反応で出て来る光の色は、電子が飛び降りるエネルギーの落差で決まります。もちろん、落差が大きければ波長の短い青系の光が、落差が小さければ波長の長い赤系の光が出ますし、落差がさらに大きく、あるいは小さくなれば、目に見えない紫外線や赤外線が出ることになります。この落差は元素の種類で決まっていますから、特定の元素からは特定の色の発光が見られるわけです。リチウム、ストロンチウムの赤、ナトリウムの黄色、カリウムの紫、カルシウムの橙、バリウム、銅の緑などが有名ですね。
有機化学を専攻した方なら、炎色反応の関連で、バイルシュタインテストというのをご存知でしょう。焼いた銅線の先に有機物を付けて炎の中に入れると、その有機物にハロゲン(塩素、臭素、ヨウ素)が含まれていた場合に、青緑色の炎色反応が見られるというものです。このところ注目されているダイオキシンは塩素を含んだ有機物を燃やした時にできることがあるので、プラスティックなどに塩素が含まれているかどうかを簡単に見分けられる方法として紹介されていることもあります。このテストでは、ハロゲン自体が発光しているわけではありません。銅を焼くことによってできた酸化銅がハロゲンと反応してハロゲン化銅になり、これが熱で揮発・分解して原子状の銅になることで、銅の炎色反応が出ているのです。酸化銅のままではいくら加熱しても金属銅には戻りませんが、一度ハロゲン化物になってしまえば、揮発・分解しやすくなるのです。
ついでに言うと、ガスバーナーやアルコールランプの炎の青色、これも炎色反応と同じように、熱で励起されたことによる発光です。ただし、光っているのは金属原子ではなく、燃料が燃えた時にできる炭素や水素、酸素がいくつか組み合わさった化合物です。この中には、炎の中ぐらいしか存在できない、不安定な中途半端な化合物も含まれています。また、空気が不足したガスバーナーやロウソクの炎が黄色や赤色になるのは、酸素が不足して燃えきれなかった炭素の塊、つまりススが熱せられて、先の黒体輻射の原理で発光したもので、ロウソクの炎は2000Kぐらいの黒体に相当する色になっています。
光から光へ ― 蛍光とりん光 ―
炎色反応では熱によって励起状態を作っていましたが、光によって励起状態を作ることもできます。ちょうど発光とは逆の過程ですね。そして励起状態から基底状態に戻る時に、再び光を外に出します。これが蛍光やりん光です。ただし励起状態と言ってもエネルギー状態は一つではなくて、いくつかの違った状態があり、熱を出しながら低い(と言っても基底状態よりは高い)エネルギー状態に一旦落ち着いて、そこから基底状態に落ちて発光するのが普通です。そのため、初めに当てた光と同じ波長(色)の光が出ることはほとんどなく、いくらかエネルギーを失った、波長の長い光が出ます。例えば、いろいろな成分を含んだ白色光(太陽光や蛍光灯の光)を当てると、その中の波長の短い青色の光を吸収して励起状態になり、それより波長の長い緑色の光を出す、というぐあいです。
それでは、蛍光とりん光の違いは何でしょうか? 一般的な常識(この言葉がクセ者)としては、光を当てている間だけ光るのが蛍光で、光を当てるのを止めた後もしばらく光り続ける、つまり寿命が長いのがりん光、ということになっています。これは必ずしも間違いとは言えないのですが、もうちょっと科学的な解釈を加える必要があります。図4を見てください。
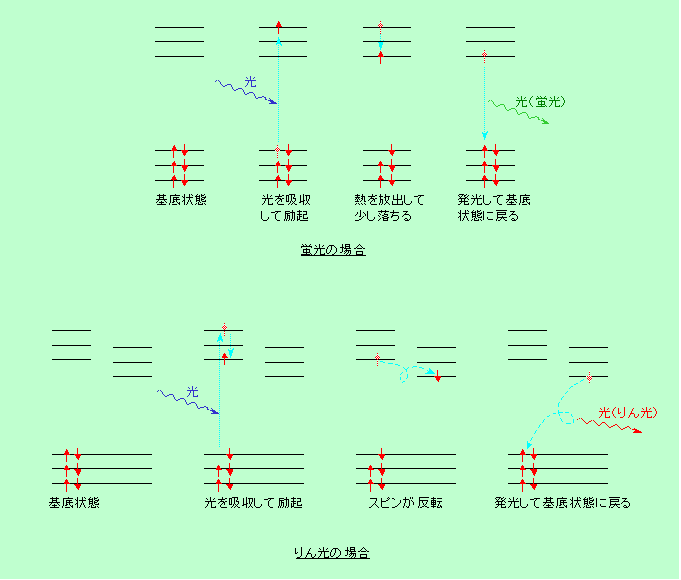
図4 蛍光とりん光を出す時の電子のエネルギー
電子には、どこのエネルギー状態にいるかということの他に、どちら向きに回転しているか、という「スピン」と呼ばれる性質があります。そして、一つのエネルギー状態の中には、スピンの向きを互いに逆にした2個の電子が入ることができます(図では赤矢印の向きでスピンを表しています)。光を吸収すると、電子は元のスピンを維持したままで高いエネルギー状態に飛び上がり、通常は落ちる時もそのままのスピン状態で落ちて来ます。この時に光を発するのが蛍光です。
ところが、近くにある他の電子軌道の影響などで、励起状態の電子のスピンがひっくり返る場合があります。このひっくり返った状態から基底状態に戻って発光するのがりん光です。この場合、飛び上がった電子のスピンは下に残った相棒の電子のスピンと同じ向きになっていますから、そのまま落っこちるわけには行きません。落ちる時にも周囲の助けを借りてスピンをもう一度ひっくり返す必要があります。また、スピンの向きが揃った電子は互いに近くにいることができないので、相棒とは少し遠ざかってエネルギーが低くなり、励起状態が多少安定化されます。このような理由から、蛍光の場合のように励起した電子が簡単には落っこちることができず、りん光の寿命が長くなるのです。ただし、りん光でもかなり寿命が短い(1000分の1秒くらいの)ものもありますから、発光の持続時間だけで区別するのは適当ではありません。
有機物の多くは、多かれ少なかれ蛍光を出します。特に染料や顔料などの色素は、基底状態と励起状態のエネルギー差がちょうど可視光の領域にありますから(だからこそ色が出る)、紫外線などを当てると蛍光を発するケースが多々あります。これに対して無機物は、たくさんの原子が密集して塊を作っていますから、せっかく励起しても周囲に熱としてエネルギーを渡してしまう場合が多く、限られた材料しか蛍光を出しません。そのため、昔の絵画などに紫外線を当てて蛍光を観察することで、その絵に使われている色材が有機系の色素なのか、岩絵具のような無機系の材料なのかを判定することもできます。
無機物で蛍光を出す材料としては、鉛やヒ素、カドミウムなどにイオウやセレンが化合したものが知られていますが、どう見てもカラダに悪そうな元素ばかりです。そのため無機系の蛍光塗料などでは、これらの単純な物質ではなく、発光の中心となる特殊な物質を母体となる化合物に添加したものが主流です。例えば蛍光灯では、アルミニウムを主体とする酸化物にユーロピウムを加えたもの(青)や、イットリウム系の酸化物にテルビウムを加えたもの(緑)、ユーロピウムを加えたもの(赤)などが使われます。これらの蛍光体が蛍光塗料として管の内側に塗られており、放電によって管内で発生した紫外線が塗料に当たると、各蛍光体がそれぞれに違った波長の可視光線を出すのです。また、最近減って来ましたが、ブラウン管の内側に塗られていて、赤、青、緑に発光しているのも無機の蛍光体です。ただしブラウン管の場合は光で励起するのではなく、電子線を当てて励起しています。ブラウン管が出て来たついでに、これに取って代わりつつある薄型テレビの一つ、プラズマテレビについても触れておきましょう。プラズマテレビの発光部分は原理的には蛍光灯とほとんど同じで、電極間に電圧をかけて内部のガスを放電させ、そこから出る紫外線を受けて赤、青、緑の蛍光体が可視光を発します。もちろん蛍光灯のように3色の蛍光体を同じところに塗るのではなくて(これでは白色になってしまいます)、画素と呼ばれる小部屋に別々に塗ってあるのですが、起こっていることは同じ。プラズマテレビは赤、青、緑の小さな蛍光灯をびっしり並べたもの、と言うこともできるのです(
ディスプレイの話参照)。
時計の文字盤や針に塗られている緑色の塗料もやはり同様の無機の材料です。これらの発光は蛍光というよりもりん光タイプの物が多く、部屋を暗くしてもしばらくは光っていますから、「蓄光塗料」とか「夜光塗料」と呼ばれています。ちなみに、一昔前までは、塗料に放射性元素を混ぜて、それが出す放射線で蛍光体を光らせる方式のものもありました。常時光っていて便利なのですが、あまり気持ちよくはありません。
衝突による発光 ― 放電 ―
適当な間隔をおいて並べた2つの電極の間に高電圧をかけると、間の空中を飛んで電気が流れる、これが放電です(電極ではなくてコイルに高周波をかける場合もあります)。電極間には、宇宙から絶え間なく降り注いでいる宇宙線によって空気などが電離してできた電子がわずかながら存在しています。あるいは、電圧が非常に高かったり電極が高温であったりすると、負極から直接に電子が引き出される場合もあります。この電子が電極間の電場によって加速され(直流なら一方向に、交流なら左右に激しく振られ)、別のガス分子にぶつかって電子を叩き出してイオン化させます。新しく発生した電子はまた別の分子にぶつかってイオン化し、そこから出た電子がまたぶつかって・・・・、ということを繰り返し、ついには雪崩をうって発生した多量の電子やイオンで大きな電流が運ばれるようになるのです。このようにガス分子が電離して多量の電子やイオンが飛び交っている状態を「
プラズマ」と呼びます。ガス分子の量が多すぎると、電子が十分に加速される前に別の分子にぶつかってしまいますから、新たなイオン化を効果的に起こすことができません。そのため一般的な放電は、圧力を下げた状態の方が簡単に起こります。ただし電気エネルギーが十分に大きければ、カミナリのように空気中でも放電は起こります。静電気のパチパチも空気中での放電ですね。
この放電の過程で、たいていの場合光が出ます。先に出て来た蛍光灯やプラズマテレビでは紫外線が出ますので、放電による発光を直接見ることはできませんが、カミナリの稲妻はよく見えますし、蛍光灯のグロー球が光るのも放電です。これらの発光は、電場で加速された電子が他の分子にぶつかって、その衝突のエネルギーで励起することによって起こります。「電気エネルギー」→「運動エネルギー」→「光エネルギー」というルートでエネルギーが移って行くわけです。
極地で見られるオーロラも放電による発光の一種です。太陽から飛んでくる電子やイオンの流れ(太陽風)が地球に到達すると、地球には磁場がありますから、その影響で電子やイオン(太陽風から来たものや、地球の大気が電離したもの)が北極や南極方向に流れ込み、大気中の分子と激しくぶつかって励起、発光するのです。
プラズマからの発光でも、励起状態の安定性によって寿命が長いものや短いものがあります。学生時代に、ガラス管で作った真空ラインに窒素ガスを流しながら、途中にマイクロ波を当てて放電を起こさせたことがありました。この時、やや紫を帯びた白っぽい明るい光が見られましたが、これが見られるのはマイクロ波が当たっている部分だけで、そこをを通過するとすぐに消えてしまいます。ところが部屋を暗くしてみると、黄緑色のボウッとした光がガラス管の中を走っており、2m以上離れた真空ポンプのところまで長く伸びている様子が観察されました。これは励起された窒素分子が出す光で、窒素のプラズマの中では安定で長寿命なものです。ちなみにオーロラが長時間輝くのは、励起状態の寿命が長いからではありません。次々に電子やイオンが供給されて励起と発光が繰り返されているのです。
電気から光へ ― エレクトロ・ルミネッセンス ―
電気で発光すると言うと、普通は電球や蛍光灯を思い浮かべるでしょう。しかし、電球は、電気→熱→光、蛍光灯は、電気→運動→光(紫外線)→光(可視光線)、というルートで発光していることは既に説明しました。それでは電気エネルギーが直接光に変わるケースはないのかと言うと、ちゃんとあります。エレクトロ・ルミネッセンス(
Electro
luminescence = EL、電場発光)と呼ばれる発光で、その一つが発光ダイオード(
Light
Emitting
Diode = LED)です。
発光ダイオードは普通のダイオードと同じように、n型半導体とp型半導体とをくっ付けた構造が基本になります。半導体の性質やダイオードの原理については
半導体の話に載せていますから、ここではエネルギー図だけを載せておきます。
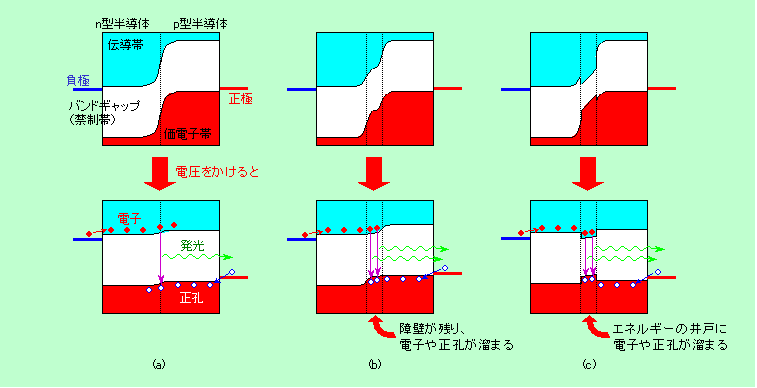
図5 発光ダイオードのエネルギー図
要するに、n型半導体の伝導帯に負極から電子が、p型半導体の価電子帯に正極から電子の抜け殻である正孔が電気的に注入されて、これらがちょうど図3や図4の飛び上がった電子(とその抜け孔)と同じように働き、電子と正孔が結合する(電子が正孔めがけて落っこちる)ことで光を出すのです。当然ながらエネルギーのギャップが大きい材料を使うほど波長の短い、高エネルギーの光が出て来ます。ただし、電子は基本的には真下(縦方向にエネルギーを表示した図では真下ですが、実際の空間では同じ位置)に落ちるのですが、図5(a)のような単純な構造では、電子や正孔が横に広がっている分、落ちる確率が低くなります。そこでn型半導体とp型半導体の間にバンドギャップの小さい別の半導体を中間層として挟むなどして、図5(b)のような2段構え構造や、図5(c)のような井戸構造を作り、電子や正孔を狭い領域に集める工夫をしています。
半導体の材料としては、GaAs(ガリウム・ヒ素)、GaP(ガリウム・リン)、GaN(ガリウム・窒素)、ZnSe(亜鉛・セレン)などを基本に、その組み合わせや、別の元素を添加したものなどが使われます。代表的な半導体であるはずのシリコンやゲルマニウムがないのが不思議に思えるかもしれませんが、それにはちゃんと理由があります。実はシリコンやゲルマニウムの中の電子はバンドギャップを一気に飛び越えるような移動の仕方はしにくく、ちょっと寄り道するルートを採りやすいのです。その理由は少々ややこしいのでここでは詳しくは書きませんが、非常に乱暴な言い方をすれば、伝導帯の底や価電子帯の天井はまっ平らではなく、伝導帯の窪んだ部分(電子が集まりやすい)と価電子帯の飛び出た部分(正孔が集まりやすい)の位置がずれていて、直接は飛び移れない、ということです。これに対してGaAsなどでは、この位置が一致していて電子が一気に飛び移ることができ、発光しやすいのです。
その昔は、発光ダイオードと言えば電気機器のパイロットランプに使われる赤や緑の弱々しい光がせいぜいだったのですが、高輝度のものや青色発光ダイオードが開発されて、今ではすっかり様変わりしました。電気エネルギーが直接光に変わるのですから、熱を経由する電球と比べて効率がよく、消費電力も小さく、寿命も長い、というわけで、信号機やら屋外用の大型ディスプレイやらに使われるようになっています。また、明るいものができるようになったために、照明としての用途も広がって来ました。照明用として使う場合には、赤や青の光だけでは具合が悪く、どうしても白色の光が必要です。蛍光灯では赤青緑の3種類の蛍光体を使って擬似的な白色を作っていました。発光ダイオードの場合にも3個を並べる方法もありますが、実用化されているのは主に青色の発光ダイオードを光源に使い、その周りを黄色の光を出す蛍光体で覆うことで、白い光を作る方式です(図6)。
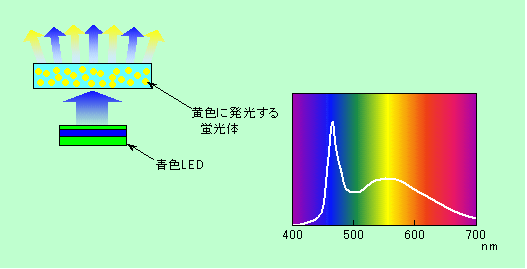
図6 発光ダイオードを使って白色光を作る方法
図にはこのタイプの照明の波長分布も示していますが、このように、青色の鋭いピークに、黄色を中心としたなだらかな発光が重なった形をしています。青と黄色は補色関係(
色の話参照)ですから、混ぜると人間の眼には白く見えるのです。最近は発光ダイオードを使った懐中電灯もよく見かけるようになりました。普通の懐中電灯の黄色っぽい光と違って青白い光で、小型でも結構明るく、乾電池1個で10時間以上持つものもあります。効率も蛍光灯に迫っていますから、やがては部屋の照明にも使われるようになるかもしれません。
発光ダイオードと同じ原理の発光体は、有機材料でも作れます。これが有機ELです。図7に代表的な有機EL素子の構造を示していますが、電子輸送層をn型半導体、正孔輸送層をp型半導体、発光層を電子や正孔を集める中間層、そして伝導帯を空の電子軌道、価電子帯を電子で満たされた電子軌道と見なせば、図5(b)の発光ダイオードと同じ構成であることがわかると思います(実は、初期の有機EL素子は発光層を電極で挟んだだけの単純な構造でしたが、発光ダイオードの場合と同じように効率アップのために改良されてこの形になったのです)。電圧をかけた時の電子エネルギーが半導体のように平らにならないのは、材料の導電性が低いために内部に均等に電場ができてしまうことによるものです(このあたりに関連する内容は
電気分解の話や
湿式太陽電池の話にも載せています)。有機ELの素子構造や動作原理は発光ダイオードとよく似ていますから、欧米では有機ELという呼び名よりも有機発光ダイオード(
Organic
Light
Emitting
Diode = OLED)という呼び名の方が普通に使われています。
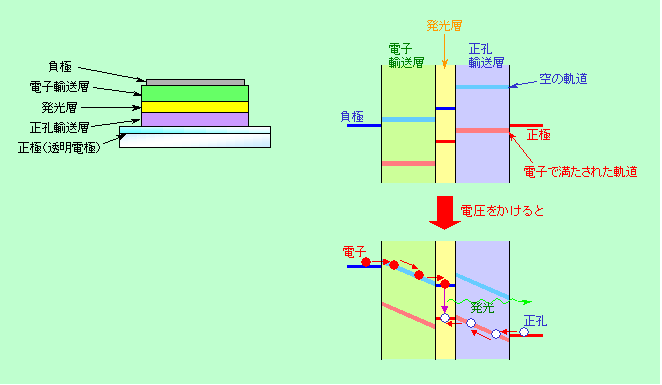
図7 有機ELの素子構造とエネルギー図
有機ELの発光原理は発光ダイオードに似ていると書きましたが、最後の部分だけ少し違っています。発光ダイオードでは電子と正孔が結合する時に開放されるエネルギーが光として出て来たのですが、有機ELでは結合時に出て来るエネルギーで有機分子を励起し、これが基底状態に戻る時に発光する、という2段構えになっています(さらに別の分子にエネルギーを受け渡す3段構えのパターンもあります)。効率を追求した結果、このような形になったのです。また効率アップに関してはもう一つ、りん光の有効利用があります。有機分子を励起する時に、図4の蛍光のパターンになる場合とりん光のパターンになる場合があり、普通は蛍光パターンよりもりん光パターンの方が多くなります(1対3)。電子のスピンが同じ向きになるりん光パターンでは基底状態に戻る時に光ではなく熱になりやすいので、以前はこの部分のエネルギーがムダに捨てられていました。しかし最近では、スピンが揃った状態からでも効率よく発光できる(つまりりん光を出す)材料が見つかっており、全体の効率が高くなっています。
有機ELの材料としては、半導体的な性質を持つ有機物が使われます。ただ、無機の半導体と比べるとはるかに電流を流しにくいので(無機物ではほとんど絶縁体とされるレベル)、各層は非常に薄くする必要があります。発光ダイオードの層がμmレベルであるのに対して、0.1μm以下、という薄さです。比較的小さな分子の場合、原料の有機物を真空中で加熱して気化させ電極上に付着させる「蒸着」という方法でこのような薄膜が作られるのが普通です。これに対して、高分子の材料を使った有機ELもあります。この場合は材料自体が膜を作りやすい性質を持っているので、塗料にしてコーティングすることで薄膜を作ることができ、大きな面積の発光素子を作るのに有利です。しかし高分子の場合はどうしても広い波長分布を持つ発光になりやすく、鮮やかな色が出しにくいことや、図7のような積層構造を作るのが難しいので旧来の一層型で性能を出す必要があるという問題があり、主流にはなっていません。それでも最近はずいぶん改良されて来ましたから、高分子材料を使った大画面の有機ELパネルが普通に見られるようになるかもしれません。
ところで、有機ELに対して、無機ELというのもあります。発光ダイオードもELの一種ですから、無機ELは発光ダイオードのことか、と思いきや、そうではありません。普通に無機ELと言った場合には、図8のような全く別の原理で発光するものを指すのです。
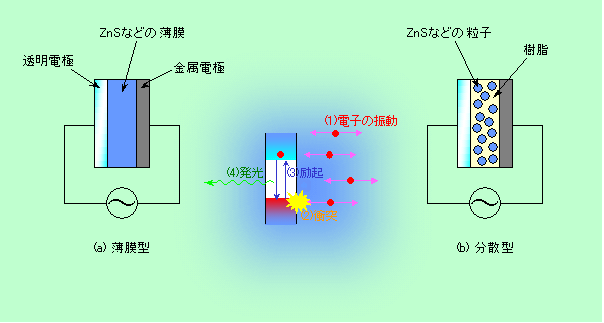
図8 有機ELとは全く違う、無機EL
構造は非常に単純で、電極の間に硫化亜鉛などの発光材料を挟んだものです。これに強い交流電場(普通は100V〜200V)をかけて内部の電子を激しく揺さぶり、それを発光体にぶつけることで励起します。原理的には高周波放電の発光によく似ていますね。実際に電流が流れることで発光する有機ELや発光ダイオードと違って電子は振動しているだけですから、電圧が高い反面、電流はほとんど流れず、電力消費が少ないのが特徴です。また、電気が素子全体を通して流れないのですから、発光する部分は電気的につながっている必要がありません。そのため必ずしも図8(a)のような連続膜になっていなくてもよく、図8(b)のように、樹脂の中に粒子状の無機物を埋め込んだ分散型でも発光します(実際、最初の無機ELは、液体の中に粉末を分散させたものでした)。このような分散型の素子はコーティングで作ることができますから、普通の無機の素子では難しいはずの、低コスト大面積、フレキシブル基板、という展開も可能です。
最近は有機ELに押されて影が薄い無機ELですが、実は本格的な開発が始まったのはこちらが先で、長時間つけっ放しにすることの多いコンビニのレジや医療機器の表示部分などで既に実用化もされています。オレンジ色に発光するモノカラーのディスプレイを見たことがある人も多いでしょう。ただ、青色の発光が難しいことや電圧が高いことがネックになって、フルカラーディスプレイなどの華やかな用途にはなかなか適用されなかったのです。しかし、元々寿命の点では有機材料をはるかに凌ぐ無機材料です。青色に発光する材料も開発されて来ていますし、コーティングによる大面積化もできるとなれば、このまま潜伏しているとは限りません。今後の動きに注目です。
整列する光 ― レーザー ―
これまでに説明してきた発光現象では、高いエネルギー状態にある電子などがそれぞれ勝手なタイミングで低いエネルギー状態に落ち、パラパラと光を飛ばしていました。これを、多くの電子が呼吸を合わせて一斉に落ちるようにしたのがレーザーです。昔は、SFに登場する武器というのがレーザーのイメージだったかもしれませんが、今では身の回りにもレーザーを使ったものがたくさんあります。レーザービームプリンターはレーザー光を走査することで感光ドラムを露光して印刷イメージを作りますし、DVDレコーダーなどはレーザー光でデータの読み書きをします。学会発表などで使われるレーザーポインターもありますし、医療用器具としても活躍しています。その他、金属やプラスティックの加工用に使われたり、スクリーンに模様を描くアートに使われたりもしています。
レーザー(LASER)と言うのは、Light Amplification by Stimulated Emission of Radiation の略で、日本語で言えば、「誘導放射による光の増幅」となります。その意味は、レーザーの発光原理を理解すればわかります。
図9はレーザーの原理を大雑把に示したものです。普通の状態では、図9(a)のように、物質の中の電子は低いエネルギー状態に多く、高いエネルギー状態には少なくなっています。エネルギーが低い方が安定なのですから、これは当然の結果です。ところが物質によっては、(熱とか光とか電気とかの)エネルギーを外から立て続けに与えると、(b)のようにエネルギーの高い状態に多くの電子を上げることができる場合があります。これを、ポンプで水を汲み上げることになぞらえて「ポンピング」と言います。もちろんポンピングされた電子のいくらかは下に落ちて来ますが、持ち上げるスピードを十分速くしてやれば、完全に上下が反転したような状態にできるのです。
この状態で電子が一個落ちたとしましょう。そこからは当然、1個の光(光子)が飛び出します(図9(c))。すると、それを引き金にして、高いエネルギーに溜まっていた電子が一斉に落下、発光します。これが誘導放射です。ただし単発の光では効果的に誘導放射を起こすことができませんので、実際のレーザーでは両側に鏡を置いて、飛び出した光を何回も往復させるようになっています(図9(d))。最初の誘導放射で飛び出した光も鏡の間を往復しますから、これが次の誘導放射を引き起こし、それがまた次の誘導放射を・・・・、という具合に次々と発光が起こって光が増幅され、多量の光が内部を往復する発振状態となるのです。もちろんこのままでは、光は永久に内部に閉じ込められて出て行けませんから、2枚の鏡のうちの一方は多少光を透過するようにしてあり、内部で発振した光を外に取り出せるようになっています(図9(e))。
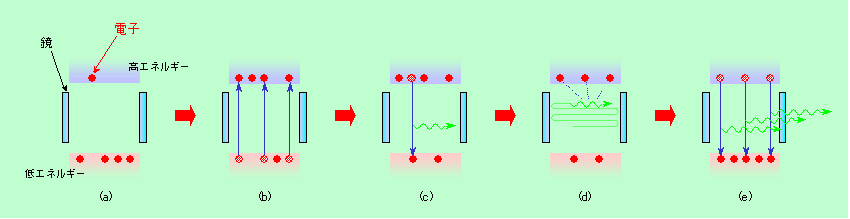
図9 レーザーの基本的な原理
誘導放射の特徴は、多くの電子がタイミングを合わせて落下することにあります。その結果、初めのきっかけになる光も含めて、放たれた光の波の山や谷は全てピタッと揃います(これを位相が揃っていると言います)。また2枚の鏡の間隔は波がピッタリ収まるように調節されており、何回反射しても、同じ方向の波は常に位相が揃い、逆方向の波どうしは、常に同じ位置で山や谷が出会う(いわゆる定在波ができる)状態になっています。発振状態ではこのように、往復している波、後から出て来る波、全ての位相が揃うことになります。さらに、鏡の反射で増幅されるわけですから、光の方向も鏡に垂直な向きに揃えられます(方向のずれた光は横から逃げてしまいます)。ということで、レーザーの光は方向が鋭く絞られた、位相の揃った(コヒーレントな)光になるのです。
ポンピングはどんな方法で行なっても構わないわけですが、図9(a)の状態が熱的に最も安定な状態(平衡状態)なのですから、熱エネルギーを与えて図9(b)の状態にするのには無理があります。というわけで、実際のレーザーでポンピングに使われるエネルギーは、主に「光」、「放電」、「電気」です。図10には、これらを使ったレーザーの模式図を示しています。
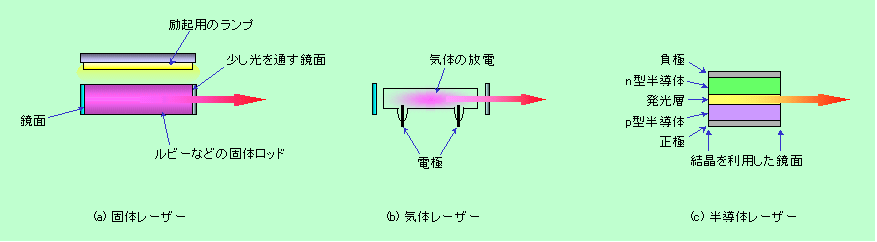
図10 実際のレーザー
図10(a)は固体のロッド(丸棒)にキセノンランプなどの別の光を当ててポンピングするタイプで、世界初のレーザーであるルビーレーザーやYAG(イットリウム・アルミニウム・ガーネット)レーザーがこれに当たります。ルビーはアルミニウムと酸素から作られた母体にクロムが混じったもので、このクロムの電子が励起されて赤色に発光し、YAGでは、ガーネット結晶に少量添加されたネオジムなどが発光中心となって赤外線を出します(特殊な素子を通して波長を半分にし、緑色の光として使う場合も多いです)。母体材料としては、透明度が高く、熱に強い(強い光で照射されてかなり熱くなる)ことが必要で、ルビーやガーネットのような宝石が適するのです(
結晶の話参照)。ルビーレーザーは効率が今ひとつで、一度発光すると、再びせっせとポンピングしなければなりませんから、ストロボのような単発の発光(パルス発光)になります。これに対してYAGレーザーは効率が高いので、十分に強い光源で励起すれば、連続の発光も可能です。
図10(b)は管の中に閉じ込めた気体の放電で発光するタイプで、ヘリウム・ネオンレーザー(赤)やアルゴンレーザー(緑)、炭酸ガスレーザー(赤外線)などがあります。いずれも内部に詰められているのは、通常は反応性の乏しい不活性な気体ですが、放電でプラズマ状態にすることによって不安定な励起状態が作られ、レーザーの発光源として動作します。光を当てて励起するのと比べて、放電では多量のエネルギーを注入しやすいですから、気体レーザーでは大出力のものが作りやすい、という利点があり、アルゴンレーザーは医療用として、炭酸ガスレーザーは加工用として活躍しています。また、ちょっと毛色の変わった気体レーザーとして、エキシマレーザーというのもあります。例えばアルゴンとフッ素というような、不活性ガスとハロゲンとを組み合わせた気体を放電状態にすると、一時的に励起された不活性ガス原子が、(電子が1個、外側の軌道に飛び出していますから)あたかも一番外側の軌道に電子を1個持つアルカリ金属原子のような振舞いをしてハロゲンとくっ付き、「エキシマー」と呼ばれる分子状のものができます。これは非常にエネルギーが高い不安定な状態で、すぐに光を発して元のバラバラな状態に戻ろうとしますから、これをレーザーに利用するのです。エキシマレーザーは波長の短い紫外線を出しますから、微細加工などに利用されています。
図10(c)は半導体レーザーですが、見ての通り、真中に発光層を挟んだ図5(c)タイプの発光ダイオードの形になっています。両端に付けられた鏡面(半導体結晶の面を利用したもの)の間で光を往復させ、発光層に溜め込んだ電子と正孔の対を一気に結合させるのです。
半導体レーザーの利点は何と言っても小型・軽量・安価なことです。電気的に電子や正孔を注入しますから、ポンピングのための別の光源や電極が不要で、鏡面付けなどの加工もしやすく、数ボルトの電圧で動作します。これらの特徴を活かして、DVDなどの光ディスクやバーコードリーダー、レーザーポインターなどに大量に使われていますし、他のレーザーのポンピング用光源に使われる場合もあります。材料の選び方によっていろいろな色のレーザーがあり、今後ますます利用が広がるでしょう。
この他に、色素の溶液を使う色素レーザーや、金属の蒸気を使うレーザーなどもありますが、きりがないのでレーザーの話はこの辺りで止めておきます。
蛍の光 ― 化学発光 ―
最後に、有機物の化学変化に伴う光、化学発光に触れておきましょう。有機物は、程度の差こそあれ、みんなエネルギーを持っています。物が燃える時に熱が出るのも、エネルギーの高い有機物が酸素との反応で酸化してエネルギーの低い物質に変わるからです。実際に火をつける場合だけではありません。動物などが生きて行くために必要なエネルギーも、食べ物を酸化することで得ているのです。化学発光も、大部分はこの酸化反応によるものです。
図11は、有機物の酸化反応による発光の様子を簡単に示したものです。普通は左側に示すように、還元状態から酸化状態に変わる時には単に熱を放出するだけです(あるいは、生物の体内などでは、この時に出るエネルギーで別の物質を還元したりもします)。ところが、ある特殊なケースでは、酸化反応の際に高いエネルギー状態に電子が残され、一種の励起状態になる場合があります。この状態から基底状態に落ちる時に発光するのです。これまで説明して来た他の発光現象では外部から何らかのエネルギーを与えて励起状態を作り出していましたが、化学発光の場合には、物質自体が持っているエネルギーが使われるわけです。

図11 化学発光の仕組み
生物の中には、このような化学反応を利用して光を出すものがあります。その代表がホタルです。ホタルの体内では、ルシフェリンと呼ばれる物質がルシフェラーゼという酵素の働きで酸化する際に励起状態となり、発光が起こります(この反応には、さらにいくつかの別の物質もかかわっていますが省略)。発光の効率は非常に高く、ほとんどムダな熱が出ない、究極の光と言えます。なお、余談ですが、ルシフェリンの発光機構は図4のりん光のパターンです。蛍の光は実は「蛍光」ではなく「りん光」だったわけです。
陸のホタルに対して、海にはウミホタルがいます。エビやカニの仲間で、大きさは2〜4mmくらい。ちょっとミジンコに似ています。このウミホタルも、陸のホタルとは少し違いますがルシフェリンとルシフェラーゼを持っており、これを体の外に放り出して海水中で発光させています。また、波などの刺激に応じてチカチカ光る夜光虫。よくウミホタルと混同されますが、こちらは赤潮の原因にもなるプランクトンの仲間で、ウミホタルと違って体の中でルシフェリンとルシフェラーゼを使って発光します。その他にも、ホタルイカや発光キノコ(ヤコウタケやツキヨタケ)など、ルシフェリンとルシフェラーゼの組み合わせで発光する生物はいろいろあります(ルシフェリンやルシフェラーゼという名前は特定の物質を指すのではなく、生物の発光の基になる物質をルシフェリン、その反応を助ける酵素をルシフェラーゼと呼んでいるのであって、生物によって化学構造や反応経路は少しずつ違っています)。
ルシフェリン/ルシフェラーゼの組み合わせによらない生物発光もあります。基本になるのは発光タンパク質と呼ばれる物質で、直接に発光にかかわる物質や酵素が予め作り付けになっています。これにカルシウムが結合すると、タンパク質の構造が変化し、それまで保護されていた発光物質が酸化して励起状態を作り出すようです。ある種のクラゲやオキアミなどが、このタイプの発光です。
生物発光ではない化学発光ももちろんあります。よく遊園地などで売られている光るリング(ケミカルライト)もそうです。プラスティック製の細い筒の中にガラス容器が仕込んであり、筒を折り曲げてガラス容器を割ると、内外の2つの溶液が混じり合うようになっています。溶液の一方にはルシフェリンに相当するシュウ酸化合物が、もう一方にはルシフェラーゼに相当する過酸化水素が含まれており、シュウ酸化合物の酸化で発生する励起状態から発光しているようです。また、刑事ドラマなどでよく出て来るルミノール反応も化学発光の一種です。ルミノールと呼ばれる化合物が過酸化水素などで酸化される時に青白く発光するのですが、この反応には触媒として鉄の錯体が必要ですので、血液(鉄錯体であるヘモグロビンを含んでいます)の痕跡を検出するのに使われるのです。
ところで、「有機物は元々エネルギーを持っている」と書きましたが、それではそのエネルギーはどこから来たのでしょうか? 言うまでもなくそれは太陽の光です。植物が太陽の光を使って、二酸化炭素と水から有機物を合成したのです。その意味では、ホタルの光も夜光虫の光も、太陽の光が形を変えたものと言えそうです。もっとも電気エネルギーだって、元をたどれば太陽エネルギーに行き着くのですが・・・・。
雑科学ホーム
hr-inoueホーム